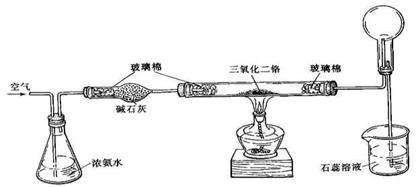
19(13分).某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置。

A B C D E F
|
|
Ⅰ |
Ⅱ |
Ⅲ |
|
备选装置 |
 |
 |
 |
请回答下列问题:
(1)装置A中烧瓶内的固体可选用________________。
a. 烧碱 b. 生石灰 c. 二氧化硅 d. 五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:
_________________________________________________________________________。
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格。
B____________;D____________;E____________(填编号)。
(4)在实验过程中应如何合理控制装置A、F中分液漏斗上口的玻璃塞?
_________________________________________________________________________。
(5)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸有___________________________________________________________;所需的玻璃仪器除酒精灯外,还需要__________________________________________ ____。
(6)请写出装置C中生成氯化铵的化学方程式_________________________ _______。
20.(13分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的方程式) 。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 ,写出发生反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A、氯水B、H2O2 C、NaOH D、Cu2(OH)2CO3实验小组设计如下实验方案:
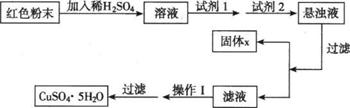
试回答:
①试剂1为 ,试剂2为 (填字母)。
②固体X的化学式为 。
 ③操作Ⅰ
。
③操作Ⅰ
。
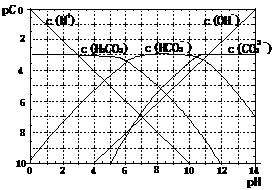
21(11分). pC类似pH,是指极稀溶液中
溶质物质的量浓度的常用对数负值。如某溶液
溶质的浓度为:1×10-3mol/L,则该溶液中该溶
质的pC=-lg1×10-3=3。已知H2CO3溶液中存在
的化学平衡为:


 CO2+H2O H2CO3 H+ +HCO3- 2H++CO32-。
CO2+H2O H2CO3 H+ +HCO3- 2H++CO32-。
右图为H2CO3溶液的pC-pH图。请回答下列问题:
(1)在pH=0-4时,H2CO3溶液中主要存在的离子为: ;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为: ;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是 ;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是 。
12.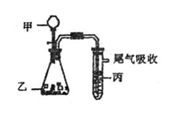 用右图装置进行实验,下表中实验结果能说明结论的是 ( )
用右图装置进行实验,下表中实验结果能说明结论的是 ( )
|
|
甲 |
乙 |
丙 |
结论 |
|
A |
水 |
电石 |
溴水 |
稳定性:水>C2H2>Br2 |
|
B |
盐酸 |
石灰石 |
苯酚钠溶液 |
酸性:HCl>H2CO3>苯酚 |
|
C |
盐酸 |
FeS |
溴水 |
还原性:S2->Br->Cl- |
|
D |
浓盐酸 |
KMnO4 |
KBr溶液 |
氧化性:KMnO4>Cl2>Br2 |

 HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O