17.(1)Al2O3 (2分 )
(2)AlO2-+CO2+2H2O═Al(OH)3↓ +HCO3- (2分)
4Fe(OH)2+2H2O+O2═4Fe(OH)3 (2分)
(3)Fe3++3H2O
 Fe(OH)3+3H+(或写化学方程式)(2分)
Fe(OH)3+3H+(或写化学方程式)(2分)
(4)NH4 NO3 、NaNO3 (2分) 0.012mol、0.028mol (2分)
18 (1)70 mL(2分);150 mL(2分);
(2)0.72(2分,写成72%也给分);
(3)
|
铝元素
存在的形态 |
物质的量( mol) |
|
Al3+(或AlCl3) |
0.03 |
|
Al(OH)3 |
0.05 |
(共4分,1格1分)。
18.(23-35班做)钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,
居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请对社会实践活动小组感兴趣的问题进行计算:
⑴将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的
NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80 g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
⑵取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224
mL(标准状况)。①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反
应后,测得的实验数据如下表所示:
|
实验序号 |
I |
II |
III |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (用
含m的代数式表示)
[答案仅供参考]
一、选择题
17.(12分)A-J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分
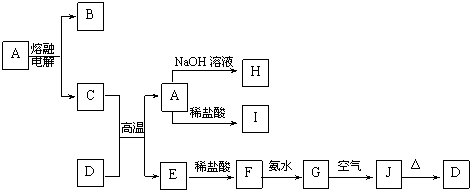 产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为 。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原
 因 。
因 。
(4)现有一定量C、E混合物与稀HNO3充分反应,
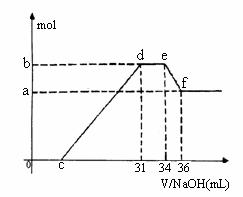
反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。坐标图c点溶液中溶质除C和E的硝酸盐外,还含有的溶质是_____________________________,其对应物质的量为
四、计算题(本题包括1小题,共10分)
18.(10-17班做) 某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验。将合金3.0克投入足量的100 mL 1.5 mol•L-1烧碱溶液中,充分反应后分离未反应的镁,然后在溶液中滴加1.0 mol•L-1盐酸,加入盐酸的体积与得到沉淀的数据如下表:
|
实验次数 |
加入盐酸的体积 |
沉淀质量 |
|
1 |
60 mL |
0 |
|
2 |
80 mL |
0.78g |
|
3 |
180 mL |
5.46g |
(1)开始沉淀时加入的盐酸体积必须大于 mL,若得到沉淀的量最大时,加入的盐酸体积为 mL;
(2)合金中铝的质量分数为 ;
(3) 如果加入240 mL盐酸后,反应体系中铝元素存在的形式有哪些?物质的量各为多少?将你的结果填入下表中:(可以不用填满)
|
铝元素存在的形态 |
物质的量( mol) |
|
|
|
|
|
|
|
|
|
 室温时,下列混合溶液的pH一定小于7的是
室温时,下列混合溶液的pH一定小于7的是