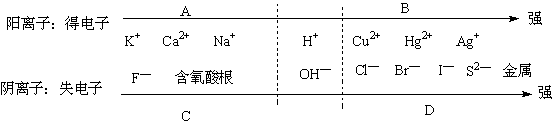
|
|
盐的类型 |
实 例 |
参加电解物质 |
溶液pH |
使溶液复原应加入物质 |
|
1、 |
A-C盐 |
Na2SO4 KNO3 |
H2O |
不变 |
H2O |
|
A的碱 |
KOH NaOH |
增大 |
|||
|
C的酸 |
H2SO4 HNO3 |
减小 |
|||
|
2、 |
B-D盐 |
CuCl2 HgCl2 |
电解质 |
不定 |
CuCl2、HgCl2 |
|
D的酸 |
HCl HBr |
增大 |
HCl、HBr |
||
|
3、 |
A-D盐 |
NaCl KBr |
H2O+电解质 |
增大 |
HCl、HBr |
|
4、 |
B-C盐 |
CuSO4 AgNO3 |
减小 |
CuO、Ag2O |
说明: ①阴阳离子在两极上放电顺序复杂,与离子性质、溶液浓度、电流强度、电极材料等都有关,不应将放电顺序绝对化,以上仅是一般规律。 ②电解过程中析出的物质的量(或析出物质的质量):在电解若干串联电解池中的溶液时,各阴极或阳极所通过的电量相等,析出物质的量取决于电路中通过的电量。 2.金属作阳极(Pt除外)时,金属失电子发生氧化反应,阴极上阳离子放电顺序不变。 四.用惰性电极电解电解质溶液的变化情况
|
类 型 |
电极反应特点 |
实 例 |
电 解 物 质 |
电解质溶液的浓 度 |
pH |
电解质溶 液复原 |
|
电解 水型 |
阴极:2H++2e-=H2↑ 阳极:4OH--4e-= O2↑+2H2O |
NaOH |
水 |
增大 |
增大 |
水 |
|
H2SO4 |
水 |
增大 |
减小 |
水 |
||
|
Na2SO4 |
水 |
增大 |
不变 |
水 |
||
|
电解电解质 |
电解质电离出的阴、阳离子分别在两极放电 |
HCl |
电解质 |
减小 |
增大 |
氯化氢 |
|
CuCl2 |
电解质 |
减小 |
增大 |
氯化铜 |
||
|
放H2生碱型 |
阴极:放出氢气生成碱 阳极:电解质阴离子放电 |
NaCl |
电解质和水 |
生成新电解质 |
增大 |
氯化氢 |
|
放O2生酸型 |
阳极:OH-放电生成酸 阴极:电解质阳离子放电 |
CuSO4 |
电解质和水 |
生成新电解 质 |
减小 |
氧化铜 |
注意:
(1)电解水型:含氧酸、强碱、活泼金属的含氧酸盐的电解;
(2)电解电解质型无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)溶液的电解;
(3)放氢生碱型:活泼金属的无氧酸盐(氟化物除外)溶液的电解;
(4)放氧生酸型:不活泼金属的含氧酸盐溶液的电解;
|
|
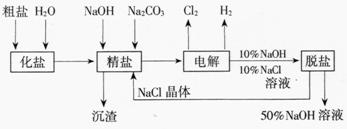
电解食盐水 |
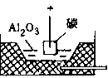
电解Al2O3(熔融态) |
电 镀 |
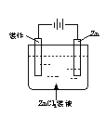
电解精炼 |
|
装置示意图 |
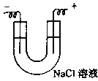 |
 |
 |
 |
|
阴极反应 |
2H++2e-=H2↑ |
4Al3++12e-=4Al |
Zn2++2e-=Zn |
Cu2++2e-=Cu
(精铜) |
|
阳极反应 |
2Cl--2e-=Cl2↑ |
6O2--12e-=3O2↑ |
Zn-2e-=Zn2+ |
Cu-2e-=Cu2+
(粗铜) |
|
电解总反应 |
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ |
2Al2O3 4Al+3O2↑ 4Al+3O2↑ |
- |
- |
|
说 明 |
(1)阴极室与阳极室应用隔膜分开。
(2)食盐水需经净化,除Mg2+、Ca2+、SO42-等离子。 |
(1)为降低Al2O3熔点,需加助熔剂(冰晶石)。
(2)阳极生成的O2与碳反应,生成CO2,需要定期更换石墨阳极。电解生成的铝积存在槽底,定期汲出。
(3)实际过程复杂,上述反应仅是粗略的表示 |
(1)镀件必须作阴极。
(2)镀层金属作阳极。
(3)用含镀层阳离子的溶液作电镀液。 |
(1)粗铜作阳极,溶解下来。
(2)精铜作阴极。 |
|
|
原电池 |
电解池 |
|
能量转化 |
化学能→电能 |
电能→化学能 |
|
反应特征 |
自发进行的氧化还原反应 |
非自发进行的氧化还原反应 |
|
电极名称 |
由电极本身决定
负极:相对较活泼金属
正极:相对不活泼金属 |
由电源决定
阴极:与负极相连
阳极:与正极相连 |
|
电极反应 |
负极:氧化反应
正极:还原反应 |
阴极:还原反应
阳极:氧化反应 |
|
装置特征 |
无电源,两极不同 |
有电源,两极可以相同,也可以不同 |
|
电子流动方向 |
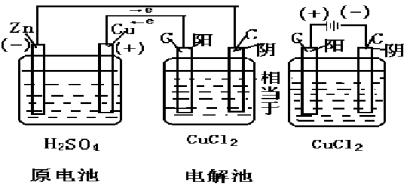 |
|
|
溶液中离子流向 |
阳离子移向正极
阴离子移向负极 |
阳离子移向阴极
阴离子移向阳极 |
|
联 系 |
两者均发生氧化还原反应 |
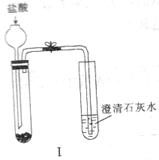
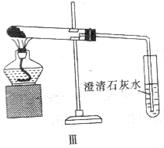
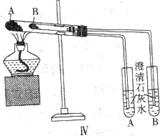
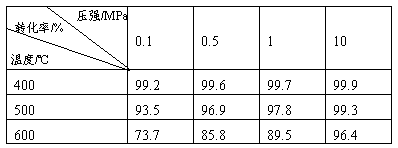
 2SO3(g);△H=-196.9kJ·mol-1,计算每生产1
2SO3(g);△H=-196.9kJ·mol-1,计算每生产1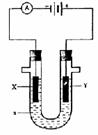 ②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
。
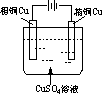
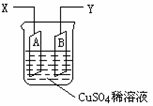 (2003年春季)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
(2003年春季)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。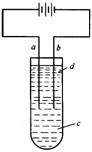 (1)a电极材料应为________,电极反应式为_________________________。
(1)a电极材料应为________,电极反应式为_________________________。