23.(11分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+
3H2O |
<< 1 |
|
2 |
Au3+
+ 4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
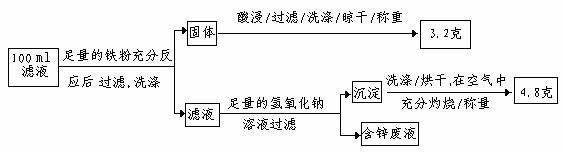
则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1
22.(10分)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:
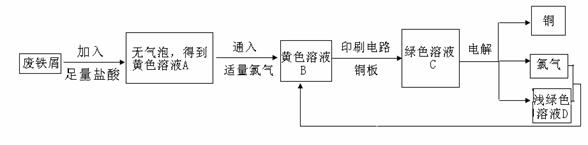
(1)写出废铁屑与盐酸反应的离子方程式: ;
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
编号 |
实验内容 |
实验操作 |
预期现象和结论 |
|
① |
检验黄色溶液A中是否含有Fe2+ |
|
|
|
② |
检验绿色溶液C中是否含有Fe3+ |
|
|
(3)电解过程中的阴极材料是
(4)采用排液法收集氯气,该液体是
21.(11分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。
实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有____ ____(填写化学试剂名称)的净化装置。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:______________________
③的试管中反应的离子方程式为
 反应完毕经冷却后,②的试管中有大量晶体析出。下图中
反应完毕经冷却后,②的试管中有大量晶体析出。下图中
符合该晶体溶解度曲线的是_______(填写编号字母);从
②的试管中分离出该晶体的方法是_________ _(填写
实验操作名称)
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为______色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,标明使用何种
化学试剂,理由__________________________________________________________
20.(12分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观]
该硫酸铵化肥无可见机械杂质。
[实验探究]
按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是”或“不是”)一等品

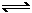 2A(?)+ B(?)
xC(g) ΔH<0
2A(?)+ B(?)
xC(g) ΔH<0
 D.断开K1,闭合K2时,OH-向b极移动
D.断开K1,闭合K2时,OH-向b极移动