0 39421 39429 39435 39439 39445 39447 39451 39457 39459 39465 39471 39475 39477 39481 39487 39489 39495 39499 39501 39505 39507 39511 39513 39515 39516 39517 39519 39520 39521 39523 39525 39529 39531 39535 39537 39541 39547 39549 39555 39559 39561 39565 39571 39577 39579 39585 39589 39591 39597 39601 39607 39615 447348
 右图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法正确的是( )
右图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法正确的是( )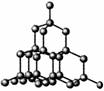 A、B、C、D均为短周期元素。A、B可形成两种液态化合物B2A2、B2A,A与C仅形成两种气态化合物CA、CA2,B可分别与A、C、D形成电子数相等的三种分子X、Y、Z,其中Y的空间结构是正四面体.则下列叙述正确的是( )
A、B、C、D均为短周期元素。A、B可形成两种液态化合物B2A2、B2A,A与C仅形成两种气态化合物CA、CA2,B可分别与A、C、D形成电子数相等的三种分子X、Y、Z,其中Y的空间结构是正四面体.则下列叙述正确的是( ) 、N2、OH-、B中阴离子、W的阴离子,分别填入下面对应的横线上,组成一个配平的化学方程式:
、N2、OH-、B中阴离子、W的阴离子,分别填入下面对应的横线上,组成一个配平的化学方程式: + + == + + + H2O
+ + == + + + H2O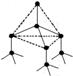 15.(14分)下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
15.(14分)下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。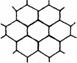



 16.(10分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如右图所示:
16.(10分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如右图所示: