9.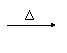 下述有机物的变化中,属于消去反应的是 ( )
下述有机物的变化中,属于消去反应的是 ( )
A.CH3CH2CH2OH +CuO CH3CH2CHO +H2O + Cu
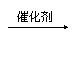
 B.CH3-C≡CH+HCl
CH3CCl==CH2
B.CH3-C≡CH+HCl
CH3CCl==CH2
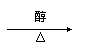
C.CH3CH2CH2Cl+NaOH CH3CH==CH2+NaCl+H2O
 |
|||
|
|||
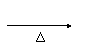
D.CH3CH2CH2Cl+NaOH CH3CH2CH2OH+NaCl
9.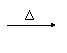 下述有机物的变化中,属于消去反应的是 ( )
下述有机物的变化中,属于消去反应的是 ( )
A.CH3CH2CH2OH +CuO CH3CH2CHO +H2O + Cu

 B.CH3-C≡CH+HCl
CH3CCl==CH2
B.CH3-C≡CH+HCl
CH3CCl==CH2
C.CH3CH2CH2Cl+NaOH CH3CH==CH2+NaCl+H2O
 |
|||
|
|||
D.CH3CH2CH2Cl+NaOH CH3CH2CH2OH+NaCl