摘要:23.(B)下表是元素周期表 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ (1)⑤的元素符号是 ,在上述周期表用元素符号标出铁元素所在的位置. (2)表中最活泼的金属是 .非金属性最强的元素是 , (3)表中能形成两性氢氧化物的元素是 .分别写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式: , (4)请设计一个实验方案.比较⑦.⑩单质氧化性的强弱: . 产品标准 GB5461 产品等级 一级 配 料 食盐.碘酸钾.抗结剂 碘含量 20~50mg/kg 分装时期 分装企业
网址:http://m.1010jiajiao.com/timu3_id_384628[举报]
下表是元素周期表的一部分,根据下表用元素符号或化学式填空:
(1)这九种元素分别为A
F
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是
(3)A、B、C三种元素按原子半径由大到小的顺序排列为
(4)写出F元素的氢化物在常温下跟B元素的单质发生反应的化学方程式并标出电子转移的方向和数目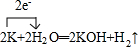
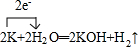 .
.
(5)H元素跟A元素形成化合物的电子式是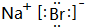
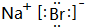 .高温灼烧该化合物时,火焰呈
.高温灼烧该化合物时,火焰呈
(6)H元素和G元素两者核电荷数之差是
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
Na
Na
、BK
K
、CMg
Mg
、DAl
Al
、EC
C
、F
O
O
、GCl
Cl
、HBr
Br
、RAr
Ar
,其中化学性质最不活泼的是Ar
Ar
.(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是
NaOH
NaOH
.(3)A、B、C三种元素按原子半径由大到小的顺序排列为
K+>Na+>Mg2+
K+>Na+>Mg2+
.(4)写出F元素的氢化物在常温下跟B元素的单质发生反应的化学方程式并标出电子转移的方向和数目
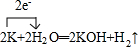
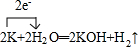
(5)H元素跟A元素形成化合物的电子式是
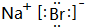
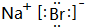
黄
黄
色.(6)H元素和G元素两者核电荷数之差是
18
18
. 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
(1)写出下列元素的元素的符号:F
F
F
、JAr
Ar
.(2)G元素与E元素形成的化合物的化学式是
Na2O
Na2O
、Na2O2
Na2O2
,它们都是离子
离子
(填“离子”或“共价”)化合物.(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是
HClO4
HClO4
,属于两性氢氧化物的是Al(OH)3
Al(OH)3
(用化合物的化学式表示).(4)只含有A、C两种元素的化合物称为
烃
烃
,这些化合物中:①相对分子质量最小的是
CH4
CH4
,该化合物的分子空间构型是正四面体
正四面体
;②分子中含有双键,但原子数最少的是
CH2=CH2
CH2=CH2
,它与HCl反应的化学方程式为CH2=CH2+HCl→CH3CH2Cl
CH2=CH2+HCl→CH3CH2Cl
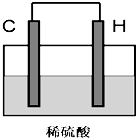
;(5)将H单质与C的一种单质(导体)按如图装置连接,该装置称为
原电池
原电池
.其中C极为正极
正极
,(填正负极)并写出该电极反应式为:2H++2e-=H2↑
2H++2e-=H2↑
.电子流动方向H流向C
H流向C
.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o |

试回答下列问题:
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
Si
Si
(填元素符号);(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
CO2
CO2
,该分子是由极性
极性
键构成的非极性
非极性
分子(填“极性”或“非极性”);元素d的氧化物的分子式是N2O
N2O
.(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
12
12
,一个晶胞中i原子的数目为4
4
;晶胞中存在两种空隙,分别是正四面体空隙
正四面体空隙
、正八面体空隙
正八面体空隙
.下表是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替)
(1)用电子式表示AD2的形成过程
 .
.
(2)写出C的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物反应的离子方程式
(3)请设计实验比较B、F的金属性强弱顺序.
查看习题详情和答案>>
族 周期 |
ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | 0族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |


(2)写出C的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.(3)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 金属性:B > > F(填“>”、“<”或“=”) | ||
| F |
下表是元素周期表的一部分,据此请回答下列问题.
(1)化学性质最不活泼的是(填名称,下同)
E原子的结构示意图
 F离子的结构示意图
F离子的结构示意图

(2)C最高价氧化物的水化物分别与A、G最高价氧化物的水化物反应的离子方程式
(3)G元素和A元素形成的化合物的电子式是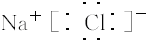
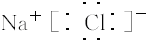 .
.
(4)A、B、C、G四种元素对应离子半径的由大到小顺序是
(5)某元素的原子L层电子数比K层电子数多3个,该元素在元素周期表中位于
查看习题详情和答案>>
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
氦
氦
,金属性最强的是钠
钠
,非金属性最强的是氟
氟
.E原子的结构示意图




(2)C最高价氧化物的水化物分别与A、G最高价氧化物的水化物反应的离子方程式
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
,Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.(3)G元素和A元素形成的化合物的电子式是
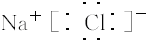
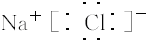
(4)A、B、C、G四种元素对应离子半径的由大到小顺序是
Cl->Na+>Mg2+>Al3+
Cl->Na+>Mg2+>Al3+
(用离子符号表示).(5)某元素的原子L层电子数比K层电子数多3个,该元素在元素周期表中位于
第二周期ⅤA族
第二周期ⅤA族
(周期、族)