27.某校课外实验小组同学设计下图装置进行实验。(夹持装置已略去)。
(1)该小组同学用如图装置进行“乙炔的制取及燃烧性质验证”实验。
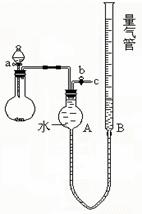 ①制取乙炔的化学方程式是
。
①制取乙炔的化学方程式是
。
②点燃乙炔前,需要验纯。简述检验可燃气体纯度的操作方法:
。
③在导管口c处点燃乙炔,观察到的现象是
;
(2)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是: ,并使视线与凹液面最低处相平。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
|
|
饱和醇的质量 |
金属钠的质量 |
量气管第一次读数 |
量气管第二次读数 |
|
① |
0.62 g |
5 .0g(足量) |
40 mL |
264 mL |
|
② |
0.31 g |
2.5 g(足量) |
40 mL |
152mL |
已知该饱和醇的相对分子质量为62。根据上述数据可确定该饱和醇是 元醇。
23.
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si |
P |
S |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
As |
Se |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Te |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
At |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
117 |
|
(1)从表中可以看出,除H外,其余非金属元素原子_________(填序号)
a.最外层电子数都大于4 b.最外层电子数都大于电子层数
(2)以下方法可以比较S、Cl非金属性强弱的是_________(填序号,答案可能不止一个)
a.分别测定Na2S溶液和NaCl溶液的pH
b.将Fe分别与S、Cl2反应,分析产物中Fe的化合价
c.将H2S通入氯水中,观察到有淡黄色固体析出:H2S + Cl2 → 2HCl + S↓
(3)以下关于元素的用途中叙述正确的是__________(填序号,答案可能不止一个)
a.P、S、Cl等元素的化合物常用来制取农药 b.Si、Ge可用于制半导体材料
c.钨是熔点最高的金属,可与钠制成合金
(4)近期,有科学家宣布,他们通过分析182 72Hf和182 74W的相对含量,发现月球的产生起码比地球早700万年。这里的“182”是指原子的_____________(填序号)。
a.质子数 b.中子数 c.质量数 d.相对原子质量
(5)美俄科学家2006年10月5日宣布他们制得了118号元素。试分析,若制得117号元素(位置见表),按元素周期表中金属与非金属的分区,它应是一种________(选填“金属”、“非金属”)元素,写出117号元素最外层电子排布式___________。
 右图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
右图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
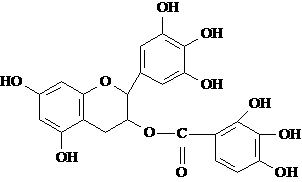
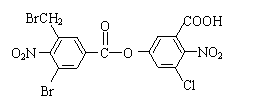 已知卤代烃在碱性条件下,易水解。某有机物的结构简式如下:
已知卤代烃在碱性条件下,易水解。某有机物的结构简式如下: