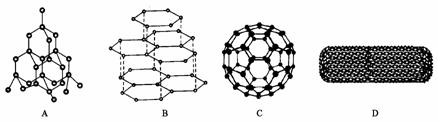
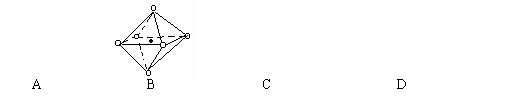15、现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下Z的单质和T的单质状态不同 b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
12、下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)d元素名称为 ,其基态原子的电子排布式为 。
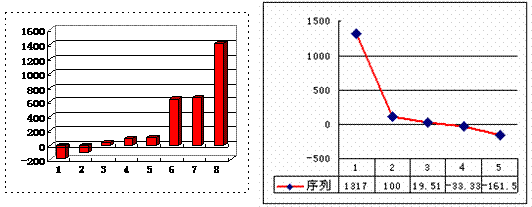
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 (填化学式),是 晶体。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,空间构型为 ;序列“2”的氢化物的结构式为 ,其中心原子的杂化轨道类型是 杂化。
10、下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
M |
D |
E |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
H |
I |
|
|
|
|
|
|
|
N |
|
J |
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是________________(填“元素符号”);
(2)下列叙述正确的是_____________(填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA4+离子的空间构型 ,ME2的空间构型 ;
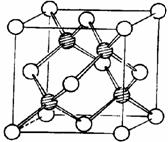
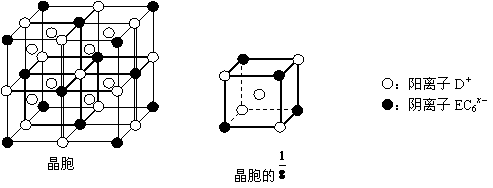
(4)元素F和元素I形成的化合物是 晶体(填晶体类型), 右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素F和元素I所在位置。
(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,该配合物中的配位体为 。
7、Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
⑴ Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,
在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮
等有机溶剂。据此判断三氯化铁晶体为 ;
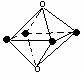
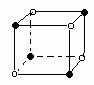
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞
分别如右图所示。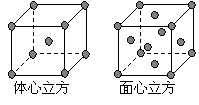 面心立方晶胞和体心立方晶胞中实际
面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为 。

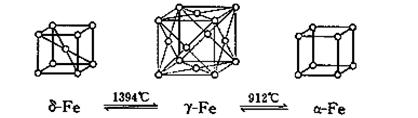 D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同