2.(15分)二氧化硫是污染大气形成酸雨的主要有害物质之一,如果了解二氧化硫的性质,它在我们的生活中也有广泛的用途。
(1)下列可产生二氧化硫污染大气的是 。(填序号)A.含硫矿石的冶炼
B.大量化石燃料的燃烧 C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品.每隔一段时间测定该雨水样品的pH变化数据如下
|
测试时间段 |
0 |
1 |
2 |
3 |
4 |
|
雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析雨水样品PH变化的原因(用文字和化学方程式说明)
。
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告。
|
序号 |
二氧化硫的性质 |
主要操作和现象 |
化学方程式 |
|
① |
|
 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 |
|
|
② |
氧化性 |
|
|
|
③ |
|
将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
|
(4)目前,我国大都使用以亚硫酸类化合物为主的漂白剂,通过产生的二氧化硫而使食品漂白。我国《食品添加使用卫生标准》规定:“亚硫酸用于蜜饯、葡萄糖中的残留量(以二氧化硫计)不超过0.05 g/kg”。目前通常采用滴定法测定食品中残留二氧化硫的含量。具体实验方法主要是:样品经处理后,加入氢氧化钾使残留的二氧化硫以亚硫酸盐的形式固定,再加入硫酸使二氧化硫游离,用碘标准溶液滴定二氧化硫。在滴定时用 (填名称)作指示剂,滴定终点的现象是 。
(5)现有100 g二氧化硫含量超标的蜜饯样品经过处理后,配制成1000mL溶液,取出50 mL溶液,分别与氢氧化钾、硫酸反应,再用碘标准溶液 5 103mol/L滴定,消耗碘标准溶液5 mL,则样品中二氧化硫的含量(g/kg)为
(保留二位小数)。
103mol/L滴定,消耗碘标准溶液5 mL,则样品中二氧化硫的含量(g/kg)为
(保留二位小数)。
1.(15分)某有机物A的分子式为C6H8O7,对其进行如下实验。 ①将 1.92 g A与100 mL 0.3 mol/L碳酸氢钠溶液混合,恰好反应。 ②在一定条件下,能与乙酸发生酯化反应。
请根据题目要求回答问题。
(1)推测A的分子结构中具有的官能团 (写名称)。
(2)若经测定A的结构中无甲基,则A可能的结构简式有 种。其中一种结构为柠檬酸,已知柠檬酸结构中相同的官能团不是连接在同一个碳原子上,且柠檬酸在铜催化条件下不会被氧化,则柠檬酸的结构简式为 。
(3)写出柠檬酸与足量碳酸氢钠溶液反应的化学方程式 。
(4)在一定条件下柠檬酸可以发生化学反应的类型有 (填序号)。
A.取代反应 B.加成反应 C.消去反应 D.中和反应 E.加聚反应
(5)柠檬酸和部分有机物的熔沸点见下表
|
|
乙酸 |
乙醇 |
乙酸乙酯 |
柠檬酸晶体 |
柠檬酸乙酯(液体) |
|
沸点(℃) |
118 |
78.5 |
77.1 |
|
294 |
|
熔点(℃) |
|
|
|
153 |
-55 |
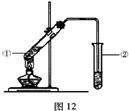 由数据分析柠檬酸与乙醇发生酯化反应,用如图12的装置,
由数据分析柠檬酸与乙醇发生酯化反应,用如图12的装置,
在试管②中,能否收集到柠檬酸乙酯(填“能”或“不能”),原因是 。
(6)写出柠檬酸与足量乙醇完全酯化反应的化学方程式
。
29. (15分)有原子序数依次增大的六种短周期主族元素A、B、C、D、E、F。其中A
与D、B与E分别同主族,B原子最外层电子数为内层电子数的2倍;F元素的原子半径在所在周期的主族元素中最小;C与A、D都可形成两种化合物,且所形成的化合物中各有一种具有漂白性。B、E分别与C形成的化合物晶体类型不同。试回答下列问题。
(1) C、D以原子个数比为1∶1形成的化合物的电子式为 。
(2) E单质的晶体类型是________________。
(3)试写出工业用电解溶液法得到单质F的离子方程式 。
(4) 写出以上六种元素形成的含18个电子的分子式 (任写三种)。
(5) 已知几种元素之间形成的化学键的键能如下:
|
化学键 |
A-A |
A-F |
B-E |
C-E |
E-E |
E-F |
|
键能(kJ/mol) |
436 |
431 |
347 |
460 |
176 |
360 |
工业上用含有E、F两种元素(原子个数比为1∶4)的化合物在高温下与A单质反应来得到高纯度的单质E。则该反应的热化学方程式为:_____________________________。
附加题.
 (其中I、II为未知部分的结构),为推测X的分子结构,进行如下图所示的转化:
(其中I、II为未知部分的结构),为推测X的分子结构,进行如下图所示的转化: 



 配制一定溶质质量分数的溶液
配制一定溶质质量分数的溶液


 +C17H35COOC2H5
+C2H5OH
+C17H35COOC2H5
+C2H5OH 实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:
实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法: