0 38086 38094 38100 38104 38110 38112 38116 38122 38124 38130 38136 38140 38142 38146 38152 38154 38160 38164 38166 38170 38172 38176 38178 38180 38181 38182 38184 38185 38186 38188 38190 38194 38196 38200 38202 38206 38212 38214 38220 38224 38226 38230 38236 38242 38244 38250 38254 38256 38262 38266 38272 38280 447348
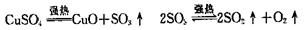


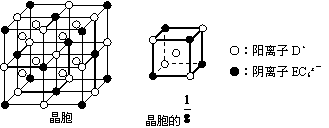 (4)C、D、E可组成离子化合物DxEC6,其晶胞结构如下图所示,阳离子
(4)C、D、E可组成离子化合物DxEC6,其晶胞结构如下图所示,阳离子 ③______________________________
④Na2SO3+S △ Na2S2O3
③______________________________
④Na2SO3+S △ Na2S2O3 10.下列关系中,A为正盐,C的相对分子质量比D的相对分子质量小16;E是一种酸,且E可用于配制王水;A、B、C、D、E中均含同一种元素;在含盐酸的品红溶液中加入A盐后,可使品红溶液褪色;向该溶液中加入一定量的X后;加热溶液又变成红色,常温时,0.1 mol/L的X溶液的pH=13。
10.下列关系中,A为正盐,C的相对分子质量比D的相对分子质量小16;E是一种酸,且E可用于配制王水;A、B、C、D、E中均含同一种元素;在含盐酸的品红溶液中加入A盐后,可使品红溶液褪色;向该溶液中加入一定量的X后;加热溶液又变成红色,常温时,0.1 mol/L的X溶液的pH=13。 (NH4)2SO4分解 B.有
(NH4)2SO4分解 B.有 原子被还原
原子被还原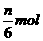 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O