28.(10分)已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
|
|
|
|
|
…… |
|
A |
|
|
B |
|
C |
|
|
D |
|
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 周期 族;D的电子排布式为: 。
(2)A和D的氢化物中,沸点较高的是 ,原因是
;A和B的离子中,半径较小的是 (填离子符号)。
 (3) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是
。
(3) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是
。
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。
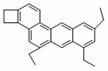 29.(10分)(Ⅰ)(3分)下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。
29.(10分)(Ⅰ)(3分)下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。
(1)doggycene的分子式为________________。
(2)1mol该物质在氧气中完全燃烧生成CO2和水的物质的量
之比为______。
(3)该分子中所有碳原子__________(填“可能”或“不可能”)处于同一平面。
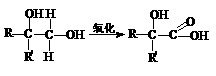 (Ⅱ)(6分)分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
(Ⅱ)(6分)分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
。
为了合成惕各酸苯乙酯,某实验室的科技人员设计了下列合成路线:
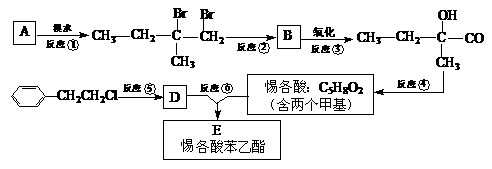
试回答下列问题:
(1)用系统命名法命名A的名称为_____________;B的结构简式为_______________。
(2)反应②中另加的试剂是_______________;在惕各酸同分异构体中,含“C=C”甲酸的酯共有_______种。
(3)试写出反应⑥的化学方程式:______________ __________________。
(4)上述合成路线中属于消去反应的是 (填编号)。
肇庆市中小学教学目标管理
23.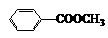 (16分)苯甲酸甲酯:
(16分)苯甲酸甲酯:
|
|
苯甲酸 |
甲醇 |
苯甲酸甲酯 |
|
熔点/℃ |
122.4 |
-97 |
-12.3 |
|
沸点/℃ |
249 |
64.3 |
199.6 |
|
密度/g·cm-3 |
1.2659 |
0.792 |
1.0888 |
|
水溶性 |
微溶 |
互溶 |
不溶 |
( )是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
有关物质的物理性质见右表。
Ⅰ苯甲酸甲酯的合成和提纯。
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应;第二步:水洗提纯;第三步:蒸馏提纯。
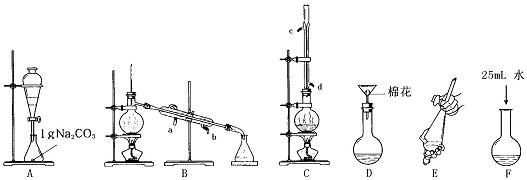
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有15.0g苯甲酸和20.0mL过量的甲醇外,还需要加入___________、______________ 。
(3)步聚F向酯化完成后,卸下的烧瓶中加入25mL水的作用是_____ ___ _ __;A装置中固体Na2CO3作用是_______ __。
(4)步骤E的操作要领是 。
(5)装置A的分液漏斗中液体分为两层,苯甲酸甲酯应在 (填上、下)层;B装置蒸馏时,接收苯甲酸甲酯前(温度<199.6℃)锥形瓶中得到的物质是 。
(Ⅱ)苯甲酸甲酯的皂化反应
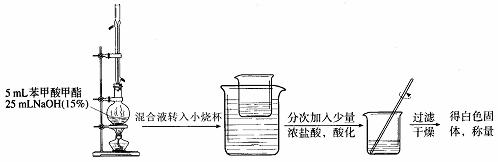
① ② ③
(6)装置①中冷凝管的作用是: ;
能说明①装置中反应完全的现象是_____________。
(7) 在③中得到白色固体的质量为5.9g。假设反应(Ⅰ)和反应(Ⅱ)中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,其它步骤的转化效率为100%,请计算酯化反应中苯甲酸的转化率,写出简要计算过程:
22.(6分)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?请你参与他们的探究过程。
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂。
(2)[实验验证]:
|
|
实验步骤 |
实验现象 |
实验结论 |
|
实验一 |
将带火星的木条伸入装有过氧化氢溶液的试管中 |
木条不复燃 |
|
|
实验二 |
|
木条复燃 |
Al2O3能加快H2O2溶液的分解速率 |
(3)[结论]:故Al2O3能作H2O2溶液分解的催化剂。
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用。还应补充一个上述反应前后Al2O3质量是否改变的探究实验。
实验三:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行 ;
④ 。
(5)有同学认为,即使实验三中Al2O3在反应前后质量不变,要证明猜想,上述三个实验还不足够,仍需要再增加一个探究Al2O3 。
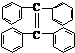
 (2)(8分)2005年诺贝尔化学奖授予法国和美国的伊夫•肖万、罗伯特•格拉布和理查德•施罗克,以表彰他们在烯烃复分解反应研究领域作出的
(2)(8分)2005年诺贝尔化学奖授予法国和美国的伊夫•肖万、罗伯特•格拉布和理查德•施罗克,以表彰他们在烯烃复分解反应研究领域作出的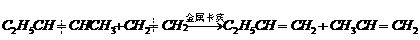 卓越贡献。烯烃复分解反应如下所示(炔烃也能发生此类反应):
卓越贡献。烯烃复分解反应如下所示(炔烃也能发生此类反应): ②写出丙炔与丙炔发生复分解反应的化学方程式:
②写出丙炔与丙炔发生复分解反应的化学方程式: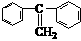
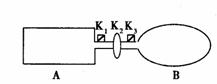 (9分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
(9分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。 N2O4(无色) △H<0
]
N2O4(无色) △H<0
]



 26.(12分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
26.(12分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下: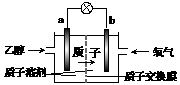 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如下图所示),比甲醇电池效率高出32倍,且安全。电池总反应为:C2H5OH+3O2==2CO2+3H2O。
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如下图所示),比甲醇电池效率高出32倍,且安全。电池总反应为:C2H5OH+3O2==2CO2+3H2O。