26.(11分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶
液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)写出所形成原电池负极的电极反应式: 。
(4)欲利用此反应测定合金中铝的金属,理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的
形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式: 。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中商加a mLC1mol·L-1NaOH之后,
 改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如下图
改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如下图
所示。
据此,回答下列问题:
(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体
积的两倍,则C1/C2= ;
(2)所加入NaOH溶液的体积a= mL。
24.(9分)不同金属离子在溶液中完全沉淀时,溶液的pH不同。
|
溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
完全生成氢氧化物沉淀时,溶液的pH |
≥3.7 |
6.4≥ |
≥4.4 |
(1)实验室配制FeCl2溶液时,需加入少许盐酸和铁粉。
①只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为 ;
②同时加入盐酸和铁粉后,溶液在放置过程中,哪些离子的浓度发生了明显的改变(不考虑溶液的挥发),并指出是如何改变的: 。
 (3)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
(3)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
①下列氧化剂中最适合做氧化剂X的是 (填序号)
A.NaClO B.H2O2 C.KMnO4 D.I2
②物质Y的化学式是 ;
③写出难溶物Z在水中的沉淀溶解平衡方程式: 。
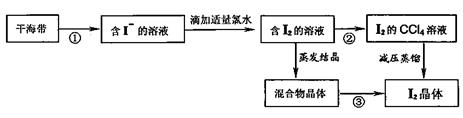 21.(8分)可通过以下步骤从干海带中提取碘
21.(8分)可通过以下步骤从干海带中提取碘
回答下列问题:
(1)操作②的名称是: 。
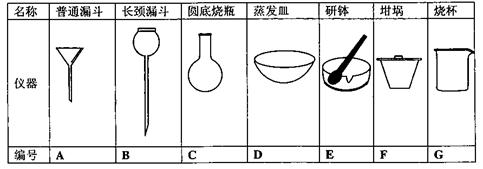 (2)进行操作①的过程中,会用到的仪器有: (选填下列仪器的编号)
(2)进行操作①的过程中,会用到的仪器有: (选填下列仪器的编号)
(3)请从上图中选取必要的仪器,画出操作③的装置图(支持仪器和热源不必画出)。
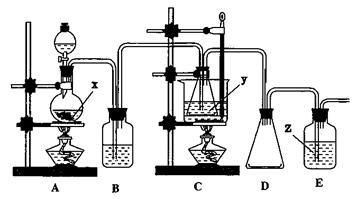 22.(13分)硫代硫酸钠(Na2S2O3
·5H2O)俗名大苏打、海波,常用于除卤剂和定影剂。Na2S2O3在酸性条件下极不稳定:S2O
22.(13分)硫代硫酸钠(Na2S2O3
·5H2O)俗名大苏打、海波,常用于除卤剂和定影剂。Na2S2O3在酸性条件下极不稳定:S2O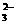 +2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃-80℃用新制的S与Na2SO3反应可制取Na2S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)
+2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃-80℃用新制的S与Na2SO3反应可制取Na2S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)
回答下列问题:
(1)写出试剂的名称:X ;装置B,D的作用是:B ,D 。
(2)实验开始时,为使反应有效地进行,下列实验操作的顺序是: (填编号)
①打开A中分液漏斗的活塞,向烧瓶中加入液体;②点燃装置A的酒精灯加热;
③点燃装置C的酒精灯加热,。
(3)反应开始后,装置C锥形瓶中的溶液先变浑浊,出现浑浊现象的原因是: 、
(用化学方程式表示);当溶液变澄清时,停止反应;然后将所得混合液趁热过滤,经加热蒸发、冷却得到硫代硫酸钠晶体。
(4)实验时,也可先在装置C的锥形瓶中加入一定量的X和Y的混合物,然后按第(2)第(3)步制取Na2S2O3。要使原子利用率达到100%,则X+Y的物质的量之比是:
。
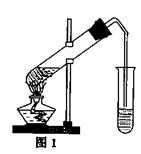 23.(9分)乙酸乙酯是重要的工业原料和溶剂,通常混有少
23.(9分)乙酸乙酯是重要的工业原料和溶剂,通常混有少
许乙醇和乙酸。某学习小组利用图1装置制取乙酸乙酯
粗产品,再分析乙酸乙酯的含量。
|
|
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点 |
77.1℃ |
78.5℃ |
117.9℃ |
操作步骤如下:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol
·L-1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH
溶液的体积为40.0mL
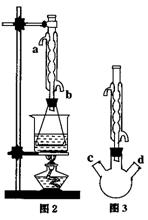 (II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol·L-1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L-1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol·L-1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L-1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)
管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸
乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不
高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中
的锥形瓶改为三颈瓶,装置如图3,在三颈瓶的c、
d口装配相关的仪器并进行恰当的操作,可以提高测
定的精确度。你认为在三颈瓶的c、d口装配相关的仪
器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议 。

 CuSO4 + H2 ↑
CuSO4 + H2 ↑

 28.(10分)(I)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:
28.(10分)(I)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如: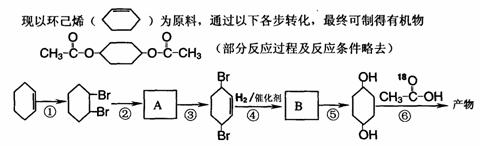
 (II)已知:卤代烃可发生如下反应:
(II)已知:卤代烃可发生如下反应:


 ①PCl5(g)
PCl3(g)+Cl2(g);△H1>0 K1=1mol·L-1
①PCl5(g)
PCl3(g)+Cl2(g);△H1>0 K1=1mol·L-1 ②CO(g)+Cl2g COCl2(g);△H1<0 K2=5×104L·mol-1
②CO(g)+Cl2g COCl2(g);△H1<0 K2=5×104L·mol-1 ③COCl2(g)
CO(g)+Cl2(g)
③COCl2(g)
CO(g)+Cl2(g)
 20.将AsO
20.将AsO +2I-+2H+
AsO
+2I-+2H+
AsO +I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
+I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作: