31.(8分)[化学--化学与技术]
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
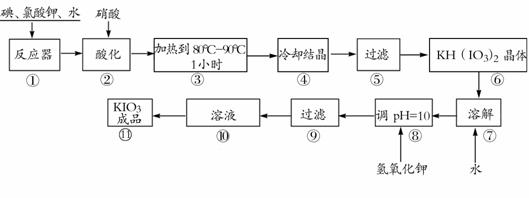
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有 ;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为: ;
(6)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
30.(15分)下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
[研究课题]探究草酸晶体受热分解的产物
[查阅资料]该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
(备注:草酸晶体失去结晶水后,175℃以上开始分解)
[提出猜想](1) ;
(2)分解产物中气体可能是CO、CO2或它们的混合物。
[设计方案](1)请设计验证“猜想(1)”的实验方案。其中所使用的试剂是 ;
(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。
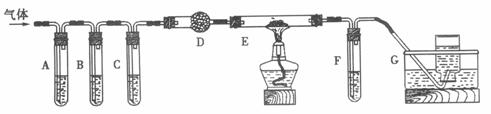
①证明分解产物中有CO2的现象是 ;
证明分解产物中有CO的现象是 ;
②装置B的作用是 ;
③若未连接装置G,要达到同样的目的,可采取的措施是 。
[交流讨论]小李同学继续查阅相关资料发现:草酸为二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李进-步研究后,对实验中CO2的检验方案提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。 。
[实验结论]写出草酸晶体受热分解的化学方程式 。
[选做部分]
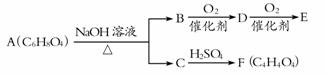
 H++SO42-。
H++SO42-。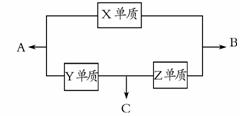 如右图所示变化:
如右图所示变化: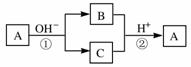 A.X元素可能为Al
A.X元素可能为Al