摘要:14.氢氧燃料电池是符合绿色化学理念的新型发电装置.右图为电池示意图.该电池电极表面镀一层细小的铂粉.铂吸附气体的能力强.性质稳定.请回答: (1)氢氧燃料电池的能量转化主要形式是 . 在导线中电子流动方向为 . (2)负极反应式为 . (3)电极表面镀铂粉的原因为 . (4)该电池工作时.H2和O2连续由外部供给.电池可连续不断提供电能.因此.大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料.吸氢和放氢原理如下: Ⅰ.2Li+H22LiH Ⅱ.LiH+H2O===LiOH+H2↑ ①反应Ⅰ中的还原剂是 .反应Ⅱ中的氧化剂是 . ②已知LiH固体密度为0.82 g/cm3.用锂吸收224 LH2.生成的LiH体积与被吸收的H2体积比为 . ③由②生成的LiH与H2O作用.放出的H2用作电池燃料.若能量转化率为80%.则导线中通过电子的物质的量为 mol. [解析] (1)电池即是把化学能转变为电能的装置,在电池中电子是从负极经导线流向正极.而氢氧燃料电池中通入H2的一极是负极.故电子由a流动到b.(2)H2在负极失电子.因为电解质溶液是KOH溶液.故负极反应式为2H2+4OH--4e-===4H2O.(3)电极表面镀铂粉可以增大电极单位面积吸附H2.O2的分子数.从而增大反应速率.(4)LiH中Li为+1价.H为-1价故反应Ⅰ中还原剂是Li.反应Ⅱ中氧化剂是H2O.由反应Ⅰ可知吸收标准状况下224 L H2时生成160 g LiH.则生成的LiH的体积是.则生成的LiH体积与被吸收的H2的体积比为:=.由②生成的20 mol LiH与H2O反应.由反应Ⅱ可知生成20 mol H2.H2-2e-.能量转化率为80%.则通过电子的物质的量为20 mol×2×80%=32 mol. [答案] (1)由化学能转变为电能 由a到b (2)2H2+4OH--4e-===4H2O或H2+2OH--2e-===2H2O (3)增大电极单位面积吸附H2.O2分子数.加快电极反应速率 (4)①Li H2O ②1/1 148或8.71×10-4 ③32
网址:http://m.1010jiajiao.com/timu3_id_87699[举报]
能源是人类生存和发展的重要支柱.请回答以下有关能源的问题:
(1)能源可分一级能源和二级能源等,直接从自然界获得的能源称为一级能源;需要依靠其他能量间接制取的能源称为二级能源.煤、煤气、石油、天然气、水能、风能和生物能等等多年来大量使用的能源,称为 能源.而电能、氢能、水煤气等都被称为 能源.
(2)煤、石油、天然气等能源以热的形式供给人们需要.写出煤、天然气燃烧供热时的化学反应方程式(试以它们各自的主要成分C和CH4代表): 、 .在质量相同时,燃料 对环境造成的负面影响(温室效应)小.
(3)科学家认为,氢气是一种高效而无污染的理想能源.以氢气作为燃料,4gH2的燃烧生成液态水时放出热量为571.6kJ,试写出表示H2燃烧热的热化学方程式: .
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,其能量转化主要形式是 ,当用KOH溶液做电解质溶液时,正极的反应式为: ,负极的反应式为: .甲烷也可以作为燃料电池的原料,此时在负极上反应的物质是 (填化学式)
查看习题详情和答案>>
(1)能源可分一级能源和二级能源等,直接从自然界获得的能源称为一级能源;需要依靠其他能量间接制取的能源称为二级能源.煤、煤气、石油、天然气、水能、风能和生物能等等多年来大量使用的能源,称为
(2)煤、石油、天然气等能源以热的形式供给人们需要.写出煤、天然气燃烧供热时的化学反应方程式(试以它们各自的主要成分C和CH4代表):
(3)科学家认为,氢气是一种高效而无污染的理想能源.以氢气作为燃料,4gH2的燃烧生成液态水时放出热量为571.6kJ,试写出表示H2燃烧热的热化学方程式:
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,其能量转化主要形式是
 氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:(1)氢氧燃料电池的能量转化主要形式是
化学能转变为电能
化学能转变为电能
,在导线中电子流动方向为(用a、b表示)由a到b
由a到b
.(2)负极的电极反应式为
2H2+4OH--4e-═4H2O或H2+2OH--2e-═2H2O
2H2+4OH--4e-═4H2O或H2+2OH--2e-═2H2O
.(3)电极表面镀铂粉的原因为
增大电极单位面积吸附H2、O2的分子数,加快电极反应速率
增大电极单位面积吸附H2、O2的分子数,加快电极反应速率
.(4)关于该电池的说法错误的是
D
D
A.氢气在负极发生氧化反应 B.供电时的总反应为:2H2+O2=2H2O
C.产物为无污染的水,属于环境友好电池 D.燃料电池的能量转化率可达100%
(5)在下图所示的装置中,能够发生原电池反应的是
BDE
BDE

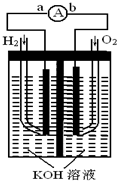 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是
化学能转变为电能
化学能转变为电能
,在导线中电子流动方向为由a到b
由a到b
(用a、b表示).(2)负极反应式为
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
.(3)电极表面镀铂粉的原因为
增大电极单位面积吸附H2、O2分子数?加快反应速率
增大电极单位面积吸附H2、O2分子数?加快反应速率
.(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是
Li
Li
,反应Ⅱ中的氧化剂是水
水
.②用锂吸收224L(标准状况)H2,生成的LiH与H2O作用后放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
32
32
mol.(5)肼一空气燃料电池是一种碱性电池,该电池放电时,肼作
负
负
极,其电极反应式为(生成无污染物质)N2H4-4e-+4OH-═N2+4H2O
N2H4-4e-+4OH-═N2+4H2O
.(1)AgNO3的水溶液呈
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
如右图所示.则图中表示醋酸溶液中pH变化曲线的是
(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸 门上的固体材料R可以采用
门上的固体材料R可以采用
A.铜 B.钠
C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是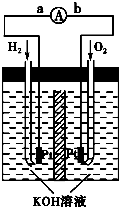 方向为
方向为
②负极反应式为
③电极表面镀铂粉的原因为
查看习题详情和答案>>
酸
酸
(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):Ag++H2O  AgOH+H+
AgOH+H+
 AgOH+H+
AgOH+H+Ag++H2O  AgOH+H+
AgOH+H+
;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的 AgOH+H+
AgOH+H+硝酸
硝酸
中,然后再用蒸馏水稀释到所需的浓度.若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式4Ag++2H2O
4Ag+O2↑+4H+
| ||
4Ag++2H2O
4Ag+O2↑+4H+
,
| ||
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
向红色溶液中加入足量BaCl2溶液
向红色溶液中加入足量BaCl2溶液
如果溶液还显红色说明甲正确,红色褪去说明乙正确
如果溶液还显红色说明甲正确,红色褪去说明乙正确
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化

如右图所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:
2Fe=2Fe2++4e-
2Fe=2Fe2++4e-
正极:O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸
 门上的固体材料R可以采用
门上的固体材料R可以采用C
C
.A.铜 B.钠
C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
负
负
极.(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是
化学能转变为电能
化学能转变为电能
,在导线中电子流动 方向为
方向为a→b
a→b
(用a、b表示).②负极反应式为
2H2+4OH-=4H2O+4e-
2H2+4OH-=4H2O+4e-
.③电极表面镀铂粉的原因为
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
. 氢氧燃料电池是符合绿色化学理念的新型 发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型 发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定,请回答: