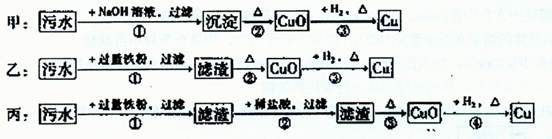
摘要:17.某地污水中含有Zn2+.Hg2+.Fe3+.Cu2+4种阳离子.甲.乙.丙三位同学设计的从该污水中回收金属铜的方案如下图所示:2溶于NaOH溶液). 甲 +NaOH溶液.过滤①△②+H2.△③ 乙 △②+H2.△③ 丙 +过量铁粉.过滤①+稀盐酸.过滤② △③++H2.△④ (1)三种实验方案中能制得纯净铜的方案是 . (2)在能制得纯净铜的方案中.会导致环境污染的操作步骤是 .污染原因是 . 改进方法是 . [解析] 甲方案污水中加NaOH所得溶液中存在Cu2+.Fe3+.Hg2+的氢氧化物.加热分解后得到Fe2O3.CuO.用H2还原后制得的Cu不纯净.且产生汞蒸气污染环境. 乙方案加入过量铁粉所得残渣中会残留铁.直接加热.还原所制得的铜不纯.同时产生Hg的污染. 只有丙方案以上两个方面均考虑到了.制得的铜是纯净的.但丙方案中会产生汞蒸气.有毒.污染环境.应增加冷凝装置加以回收.利用. [答案] ③ Hg挥发变成蒸气.Hg蒸气有毒 加上冷凝装置.将气态Hg变成液态Hg而回收
网址:http://m.1010jiajiao.com/timu3_id_87691[举报]
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
下列判断正确的是 ( )
| A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型 |
| B.乙方案中加过量铁粉可以将四种阳离子全部还原 |
| C.丙方案也发生环境污染 |
| D.三种实验方案中都能制得纯净铜 |
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:

下列判断正确的是 ( )
A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.丙方案也发生环境污染
D.三种实验方案中都能制得纯净铜
查看习题详情和答案>>
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
下列判断正确的是 ( )
A.甲方案中的反应涉及到置换、分解、化合、复分解四种反应类型
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.丙方案也发生环境污染
D.三种实验方案中都能制得纯净铜
查看习题详情和答案>>