摘要:3.“氢原子失去电子后.剩余由1个质子构成的核.即氢离子.氢离子是`裸露’的质子.半径很小.易被水分子吸引生成水合氢离子.通常用H3O+表示. 下列是某同学对这段文字的理解: ①氢离子都是裸露的质子 ②H失去电子变成裸露的质子 ③1 molH3O+含10×6.02×1023个电子 ④电子数相等.原子总数相等的粒子互为等电子体.等电子体的结构和性质相似.由此可推知H3O+呈正三角形 ⑤H3O+含极性共价键.不含非极性共价键. 其中不正确的是 ( ) A.②③ B.②⑤ C.①④ D.③⑤ 解析:氢原子包括氕.氘.氚.只有氕原子失去电子后变成裸露的质子,H3O+与NH3的原子数和电子数都相等.互为等电子体.所以H3O+呈三角锥形.H3O+中3个氢与氧形成极性共价键. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_83314[举报]
[ ]
A.②③
B.②⑤
C.①④
D.③⑤
查看习题详情和答案>>
B.②⑤
C.①④
D.③⑤
五种短周期元素的原子结构及相关物质性质的信息如下表:
请根据信息回答下列问题:
(1)E元素位于周期表第 周期第 族.B元素原子的电子排布式为 .B与C按物质的量1:1形成的化合物的电子式为 .
(2)A、D两种元素形成的化合物的空间构型为 ;它与A、B、C三种元素形成的化合物反应,除水外,还可以生成 和 .
(3)A与B、D、E分别形成的常见化合物属于 晶体,其中熔沸点最高的是 (用化学式表示)
查看习题详情和答案>>
| A | B | C | D | E | |
| 原子结构 | 失去电子后变成质子, | 最外层电子数是次外层电子数的3倍. | L层电子数等于K层和M层电子数之和. | 最外层电子排布为(n+1)sn(n+1)p(n+3). | |
| 物质性质 | 其最高价氧化物对应水化物的碱性是短周期元素中最强的. |
(1)E元素位于周期表第
(2)A、D两种元素形成的化合物的空间构型为
(3)A与B、D、E分别形成的常见化合物属于
下图表示某种分子结构的电键图,大黑点表示从1~10号的原子实(原子实指原子除去最外层电子后的剩余部分),小黑点代表未用于成键的最外层电子,短线表示成键电子对(如 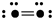 表示O2)
表示O2)
现有 A B
B  C
C  D
D 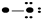
(1)据上图写出它们的化学式A
(2)写出工业制取C的化学方程式
查看习题详情和答案>>
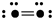 表示O2)
表示O2)现有 A
 B
B  C
C  D
D 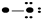
(1)据上图写出它们的化学式A
NH3
NH3
BH2O
H2O
CCO2
CO2
DHF
HF
(2)写出工业制取C的化学方程式
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
该反应为
| ||
吸热
吸热
反应(填“吸热”或“放热”)