网址:http://m.1010jiajiao.com/timu3_id_81676[举报]
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快.他决定对其原因进行探究.
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:①
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
(1)在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化.
(2)在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
若观察到实验1中③
(三)为了使实验“定量化”、使结果更精确,可以对实验进行如下改进:
1.配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol?L-1的盐酸和密度为1.225g?cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用⑤
配制溶液时还需要用到的玻璃仪器有⑦
2.比较反应速率:反应时间可以用秒表测定.如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可.⑧
阿司匹林被誉为“百年新药”,阿司匹林药片的有效成分是乙酸水杨酸,它是一种白色晶体,微溶于水.其结构简式为: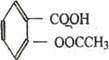 (相对分子质量为180).
(相对分子质量为180).
已知:阿司匹林药片种一般添加少量的辅料(都不溶于水,也不与![]() 反应);酚类物质与
反应);酚类物质与![]() 溶液再弱酸性质条件下能发生显色反应.
溶液再弱酸性质条件下能发生显色反应.
某课外学习小组为检验阿司匹林有效成分种的官能团并测定乙酰水杨酸再药片中的含量,进行了如下试验:
Ⅰ、验证乙酰水杨酸中具有羧基和酯的结构(-COOR).
①将一片阿司匹林研啐后溶于水,静置,各取清夜2![]() 于两支洁净的试管中;
于两支洁净的试管中;
②向一支试管中加入________,若观察到________,即证明乙酰水杨酸中有羧基;
③向另一支试管加入适量![]() 溶液,加热几分钟,冷却后逐滴滴入稀
溶液,加热几分钟,冷却后逐滴滴入稀![]() ,再向其中滴入
,再向其中滴入![]() 溶液,边加边振荡,若观察到溶液逐渐变为________色,即证明乙酰水杨酸中有酯的结构.
溶液,边加边振荡,若观察到溶液逐渐变为________色,即证明乙酰水杨酸中有酯的结构.
将上述三处空白补充完整
实验中滴加稀![]() 的作用是________
的作用是________
Ⅱ、该学习小组设计了如下试验方案测定乙酰水杨酸再药片中的含量;
①称取阿司匹林样品m![]() ;
;
②将样品研碎,溶于![]() a
a![]()
![]() 溶液(过量)并加热,出去辅料等不溶物,将所得溶液移入锥形瓶;
溶液(过量)并加热,出去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加指示剂,用浓度为b![]() 的标准盐酸返滴未反应的
的标准盐酸返滴未反应的![]() ,消耗盐酸的体积未
,消耗盐酸的体积未![]() .
.
回答下列问题:
(1)阿司匹林中加入过量![]() 溶液并加热发生反应的化学方程式为:________;其中,加热的目的是________,
溶液并加热发生反应的化学方程式为:________;其中,加热的目的是________,
(2)不能将阿司匹林溶解于水后直接用![]() 溶液进行滴定的原因是________
溶液进行滴定的原因是________
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为:________.
阿司匹林被誉为“百年新药”,阿司匹林药片的有效成分是乙酰立杨酸,它是一种白色晶体,微溶于水.其结构简式为:![]() (相对分子质量为180).
(相对分子质量为180).
已知:①阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);②酚类物质与FeCl3溶液在弱酸性条件下能发生显色反应.
某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
Ⅰ、验证乙酰水杨酸中具有羧基和酯的结构(—COOR).
①将一片阿司匹林研碎后溶于水,静置,各取清液2mL于两支洁净的试管中;②向一支试管中加入________,若观察到________,即证明乙酰水杨酸中有羧基;③向另一支试管加入适量NaOH溶液,加入几分钟,冷却后逐滴滴入稀H2SO4,再向其中滴入FeCl3溶液,边加边振荡,若观察到溶液逐渐变为________色,即证明乙酰水杨酸中具有酯的结构.回答下列问题:
(1)将上述三处空白补充完整.
(2)实验中滴加稀H2SO4的作用是________.
Ⅱ、该学习小组设计了如下实验方案测定乙酰水杨酸在药片中的含量;
①称取阿司匹林样品mg;②将样品研碎,溶于V1mLamol·L—1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;③向锥形瓶中滴加几滴指示剂,用浓度为bmol·L—1的标准盐到返滴未反应的NaOH,消耗盐酸的体积为V2mL.
回答下列问题:
(1)阿司匹林中加入过量NaOH溶液并加热发生反应的化学方程式为________;其中加热的目的是________.
(2)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是________.
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为:________.
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙.
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用到的有______(填代号).
(2)经计算,需浓H2SO4的体积为______.现有①10mL ②50mL ③100mL三种规格的量筒,应选用的量筒是______(填代号).
(3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到______ mL的容量瓶中,转移时应用玻璃棒______.转移完毕,用少量蒸馏水洗涤______2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1-2cm处.改用______加蒸馏水到瓶颈刻度的地方,使溶液的凹面恰好与刻度相切.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中:
能引起物质的量浓度偏低的是______,能引起物质的量浓度偏高的有______(填代号).
①未等稀释后的硫酸冷却即转移到容量瓶中
②定容时,仰视刻度线
③转移前,容量瓶中含有少量蒸馏水.
查看习题详情和答案>>