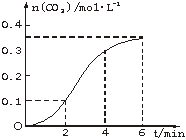
摘要:13.CaCO3与稀盐酸反应生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( ) A.反应开始2 min内平均反应速率最大 B.反应速率先增大后减小 C.反应开始4 min内温度对反应速率的影响比浓度大 D.反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 解析:首先要看明白图像.图中的曲线表明.二氧化碳的产生速率先快后慢.在第一个2 min内产生了0.1 mol CO2.第二个2 min内产生了0.2 mol CO2.第三个2 min内产生了0.05 mol CO2.反应速率先增大后减小,先增大是由于反应放热.使溶液温度升高.导致反应速率增大.4 min后速率下降则是由于浓度降低所引起的.通过计算知.A项错误.应该是2 min-4 min的平均速率最大. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_78601[举报]
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )


| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论正确的是:
 A. 反应开始4 min内温度对反应速率的影响比浓度小
A. 反应开始4 min内温度对反应速率的影响比浓度小
B. 反应4 min后平均反应速率最小
C. 反应开始2 min内平均反应速率最大
D. 反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1?(L?min)―1
查看习题详情和答案>>CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是

[ ]
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应在第2min到第4min间消耗的CaCO3质量为20g
查看习题详情和答案>>CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )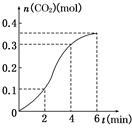
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是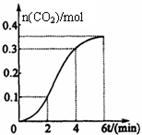
| A.反应开始2分钟内平均反应速率最大 |
| B.反应4分钟后平均反应速率最小 |
| C.反应开始4分钟内温度对反应速率的影响比浓度大 |
| D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |