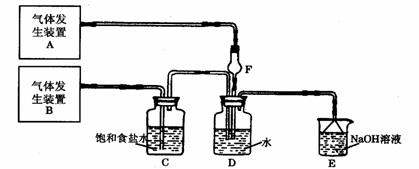
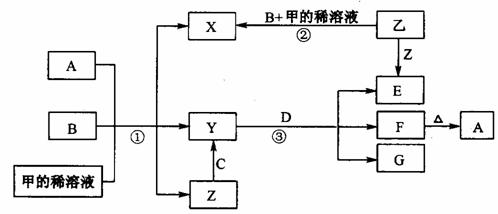
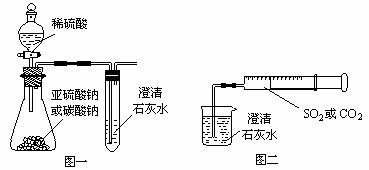
3、(2010·东方模拟)从下列事实所得出的相应结论正确的是( )
|
|
实 验 事 实 |
结 论 |
|
① |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
② |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
③ |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.③④⑤ B.②③⑤ C.①②③ D.全部
[解析]选B。电解质必须是化合物①错误;氮气与氧气难以反应是因为氮气含有三键,非金属性:N>P,④错误。
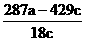 或
或 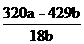
 H+ + Cl-
+ HClO ,加入的CaCO3
H+ + Cl-
+ HClO ,加入的CaCO3