12.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
|
项目 |
H2 |
N2 |
NH3 |
|
起始时 |
5 mol·-1L |
3 mol·-1L |
0 |
|
2 s末 |
2 mol·-1L |
|
|
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=____________。若此时
已达平衡,则可求得平衡常数为____________。
(2)如下图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是____________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6

若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH____________0(填“大于”或“小于”)。
(3)合成氨工业中采用了较高压强(20~50 MPa),而没有采用100 MPa或者更大压强,试解释没有这么做的理由:____________ ____________ 。
(4)在容积均为2 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol N2、6 mol H2和1 mol N2、3 mol H2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中N2
转化率分别为α甲、α乙,则甲容器中平衡常数表达式为____________(用含α甲的代数式表示),此时α甲____________(填“>”“<”或“=”)α乙。
11.(2008年上海卷)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________。已知:K300 ℃>K350 ℃,则该反应是____________热反应。
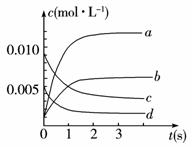
(2)右图中表示NO2的变化的曲线是____________。用O2表示从0~2 s内该反应的平衡速率v=____________。(3)能说明该反应已达到平衡状态的是____________。
a.v(NO2)=2v(O2)__________________ b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变