16.(2010·漳州模拟)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
I.定性检验
|
实验编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
|
② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液出现血红色 |
|
③ |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验②的目的是
(2)由上述实验现象推断,黑色粉末X的成分是 (填化学式)。
II.定量测定

(1)操作Z的名称是 。下列仪器中,在灼烧沉淀时必须用到的是
(填名称)

(2)写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
。
(3)通过以上数据,得出2.376 g黑色粉末X中各成分的物质的量为:
____________________________________________________________
[答案]
I.定性检验
(1)检验是否存在Fe3+ ,确认Fe3O4的存在。
(2)Fe3O4和Fe的混合物
II.定量测定
(1) 过滤、洗涤(干燥)。 坩埚、泥三角(填名称)。
(2)2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O
(3)n(Fe3O4)=0.01mol;n(Fe)=0.001mol
13.(2010·广州模拟)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01
mol/L 酸性KMnO4溶液,滴入所得溶液 |
|
|
|
步骤②:
|
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种气体 |
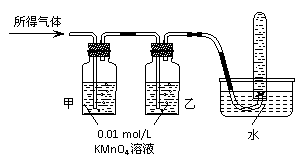

[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
[答案]
SO2、H2
猜想Ⅰ
步骤① 溶液紫红色褪去 含有Fe2+
步骤② 另取少量所得溶液,滴加KI溶液和淀粉溶液 溶液变为蓝色
猜想Ⅱ
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体
不正确 若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+
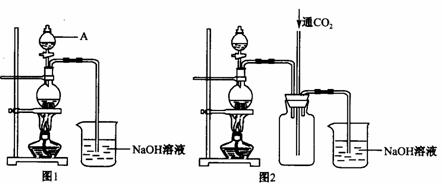

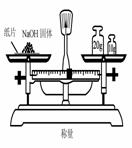
 (2010·济南模拟)实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
(2010·济南模拟)实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+  )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
 A.
B.
A.
B.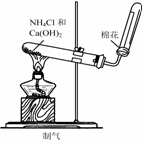
 C.
D.
C.
D.