网址:http://m.1010jiajiao.com/timu3_id_71106[举报]
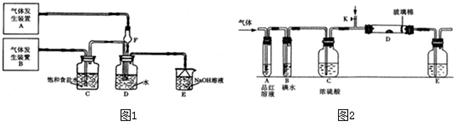
(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。

试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是 ;气体发生装置B应选择①、②、③三种装置中的 (选填序号)。
(2)D装置中主要反应的离子方程式为: 。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有 (试剂名称,下同)的试管中,再加入产生的现象是 ,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有 的试管内,产生的现象是 。
查看习题详情和答案>>
(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是 ;气体发生装置B应选择①、②、③三种装置中的 (选填序号)。
(2)D装置中主要反应的离子方程式为: 。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有 (试剂名称,下同)的试管中,再加入产生的现象是 ,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有 的试管内,产生的现象是 。
(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是 ;气体发生装置B应选择①、②、③三种装置中的 (选填序号)。
(2)D装置中主要反应的离子方程式为: 。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有 (试剂名称,下同)的试管中,再加入产生的现象是 ,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有 的试管内,产生的现象是 。
查看习题详情和答案>>
(1)某活动小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
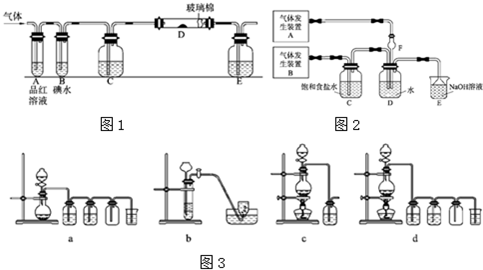
①从左端通入SO2时和通入Cl2时,装置A中观察到的现象是否相同
②装置E中盛放的物质可以为
③若装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子.该反应的化学方程式为
④若由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解.写出Cl2与含X的溶液反应的离子方程式
(2)为了探究Cl2、SO2同时通入H2O中发生的反应,某兴趣小组同学设计了如下图所示的实验装置.
①气体发生装置A产生的气体是
②实验室制备SO2和Cl2通常采用下列反应:
Na2SO3+H2SO4(浓) Na2SO4+H2O+SO2↑;
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,下列所给仪器装置中能够制备并收集干燥、纯净Cl2的装置为
③设计实验验证通入D装置中的气体是Cl2过量还是SO2过量.(简要说明实验步骤、现象和结论)
(1)气体发生装置A产生的气体是
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液
④苯酚溶液 ⑤品红溶液 ⑥酸性高锰酸钾溶液
I 若Cl2过量:取适量D中溶液滴加至盛有
II 若SO2过量:取适量D中溶液滴加至盛有
(3)另一小组设计如图所示的装置图2(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
②若装置B中装有5.0mL 1.0mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式