27.(10分)材料、能源和C60、Si60、N60是目前科学家研究的热点。请回答下列问题:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(1)单位质量的A和B单质的燃烧热大,可用作燃料。已知A和B为短周期元素,B原子的第一至第四电离能如右表所示。
①某同学根据上述信息,推断B的核外电子排布为:1s22s23s13p1,该同学所写的电子排布式违背了 ;若该原子核外第三层确有2个电子,则该元素的元素符号为 。
②A与Cl形成简单分子时A原子为sp杂化,则A与Cl形成的分子的空间构型为 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
① 科学家把C60和K掺杂在一起制造了一种富勒烯与钾的
科学家把C60和K掺杂在一起制造了一种富勒烯与钾的
化合物,该物质在低温时是一种超导体,其晶胞如右图所示,
该物质的K原子和C60分子的个数比为 。
②继C60后,科学家又合成了Si60、N60。C、Si、N原子电
负性由大到小的顺序是 ;请解释如下现象:熔点:
Si60>N60>C60,破坏分子需要的能量:N60>C60>Si60,其原因是:
。
③Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
26.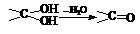 (10分)多羟基连在同一个碳原子上易自动失水生成醛或酮:
。
(10分)多羟基连在同一个碳原子上易自动失水生成醛或酮:
。
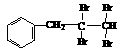
(1)根据上述原理,请写出 与NaOH的水溶液共热的化学方程式
 为:
;
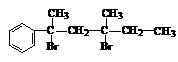
与NaOH的乙醇溶液共热,可以生成 种稳定的二烯烃。
为:
;
与NaOH的乙醇溶液共热,可以生成 种稳定的二烯烃。
(2)醛酮在水中可生成水合物: 。这是一个可逆反
 应,平衡状态(平衡的位置)决定于醛酮的结构。若
为醛酮的水
应,平衡状态(平衡的位置)决定于醛酮的结构。若
为醛酮的水
合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
|
化合物 |
 |
 |
 |
 |
|
K(H2O) |
2×103 |
1.3 |
0.71 |
8.3×10-3 |
|
化合物 |
 |
 |
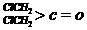 |
 |
|
K(H2O) |
2×10-3 |
2.9 |
10 |
很大 |
根据以上表中数据分析,请总结出两条结论: 。
(3)工业上生产苯甲醛 有以下两种方法:
有以下两种方法:


① ;②
与方法①相比,方法②的优点是 ,缺点是 。
(4)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
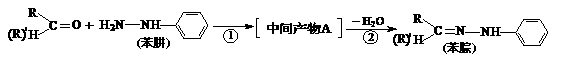
“反应①”的原子利用率为100%,则中间产物A的结构简式为 ;“反应②”的反应类型属于 。
(5)由对苯二甲醛的氧化产物“对苯二甲酸”与“乙二醇”缩聚,生成的聚酯纤维(涤纶)的结构简式为 。
23.(11分)随材料科学的发展,金属钒及其化合物得到了越来越广泛的应用。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。该工艺的主要流程如下:

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其化学方程式为 。
(2)反应①的目的是 。
 (3)测定反应②溶液中钒的含量,可用已知浓度的
(3)测定反应②溶液中钒的含量,可用已知浓度的
酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2
和VOSO4,其离子方程式为: 。
(4)已知NH4VO3在焙烧过程中150~200℃时先失
去氨;在300~350℃再失去水。请在右边座标图中画出
加热234g NH4VO3固体质量的减少值△W随温度(T)
变化的曲线。
22.(12分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
 ①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
 ②2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
②2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
 (3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
|
|
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇 (填“有利”或“不利”)。
 (4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
20. (13分)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究。
(13分)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究。
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
,其改进方法是 。
(2)改进装置后,检查一侧装置的气密性的方法是 。
(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是 。
正确操作,记录得到下表中部分实验数据。分析数据,观察实验装置图,回答下列问题:
|
A烧瓶中 |
B烧瓶中 |
20℃、101kPa 50mL量筒内气体读数 |
反应时间 |
|
|
A瓶 |
B瓶 |
|||
|
40mL0.1mol/L 醋酸溶液 |
40mL0.1mol/L 盐酸溶液 |
5mL |
t(a1)=155s |
t(b1)=7s |
|
10mL |
t(a2)=310s |
t(b2)=16s |
||
|
15mL |
t(a3)=465s |
t(b3)=30s |
||
|
20mL |
t(a4)=565s |
t(b4)=64s |
||
|
…… |
…… |
…… |
||
|
44.8mL |
t(an)=865s |
t(bn)=464s |
(4)在实验数据中:①t(a1)远远大于t(b1)的原因为: ;
②由 [用含t(b1)、t(b2)、t(b3)代数式表示] 说明盐酸是可能不存在电离平衡;由 [用含t(a1)、t(a2)、t(a3)代数式表示] 说明醋酸中存在电离平衡。
(5)通过该实验可得到的结论是(回答出两点即可):①
;② 。
21(10分)为了探究硫化钠晶体(Na2S•nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中;②三天后将样品放入盛水的烧杯中,搅拌后得无色澄清溶液;③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。
(1)请你根据上述记录,对放出气体进行猜想:
猜想①:可能是H2S ; 猜想②:可能是SO2 ; 猜想③可能是CO2;
猜想④:可能是 ; 猜想⑤:可能是 。
(2)若放出的气体是两种气体的混合气,现有:浓、稀2种品红溶液,浓、稀2种溴水,澄清石灰水,浓、稀2种盐酸溶液、试管气体发生装置,洗气瓶、试管洗气装置。请设计一个组合实验分析混合气的组成,在下表中简要写出实验方法、现象和结论:
|
实验方案 |
可能的现象和相应的结论 |
|
|
|
|
|
(3)如果要检验硫化钠晶体是否被氧化生成了硫酸钠,请简要说明检验的方法、现象和结论: 。
 ,
,