8.下列叙述正确的是 ( )
A.沸点:CH4<SiH4<GeH4<SnH4
B.离子半径:K+>Na+>S2->F-
C.非金属性:F>O>P>S
D.酸性:H2CO3<HBr<CH3COOH<HClO
|
2X(g)+Y(g) Z(g)+W(g);△H<0
Z(g)+W(g);△H<0
若改变某一条件,下列说法正确的是 ( )
A.使用催化剂或缩小容器容积,平衡均不发生移动
B.升温既可以提高反应速率又可以提高X的转化率
C.向容器中加入少量Z,平衡后混合气体中Z的体积分数变小
D.向容器中加入一定量的Y,上述反应的△H不变
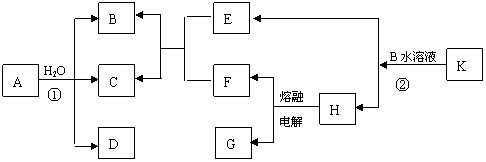
16.(10分)
(1)部分短周期元素的原子半径及常见化合价如下表:
|
元素代号 |
M |
Q |
R |
T |
X |
|
原子半径/nm |
0.160 |
0.143 |
0.099 |
0.074 |
0.102 |
|
常见化合价 |
+2 |
+3 |
-1 |
-2 |
+6,-2 |
① R元素的阴离子结构示意图为________________。
② 探究M和Q两种元素金属性强弱的实验方法是
________________________________
__________________________________________________________________。
③ 工业生产中排放的SO2用饱和Na2XO3溶液吸收可化害为利生产化工原料,该反应的化学方程式为____________________________________________________。若将金属Q的硫酸盐溶液滴加到饱和Na2XO3溶液中,观察到的现象有_________________________________
____________________________________。
(2)几种常见弱酸的电离平衡常数(25℃)如下表。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
|
H3PO4 |
H3PO4 H++H2PO4― - H++H2PO4― -H2PO4―  H++HPO42― H++HPO42― HPO42―  H++PO43- H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
① 若把HCO3-、H2PO4-、HPO42-都看作是酸,则它们的酸性由强到弱的顺序是____________________________________________________。
② 物质的量浓度相同时,Na3PO4溶液的碱性比Na2CO3溶液_______(强 / 弱)。
 ⑵该小组同学把1 mol O2和NH3的混合气体导入密闭容器中,在催化剂的作用下加热,使之充分反应,恢复到常温常压下。若整个容器中的反应随着氧气的量的增加而发生如下两个反应:
⑵该小组同学把1 mol O2和NH3的混合气体导入密闭容器中,在催化剂的作用下加热,使之充分反应,恢复到常温常压下。若整个容器中的反应随着氧气的量的增加而发生如下两个反应:
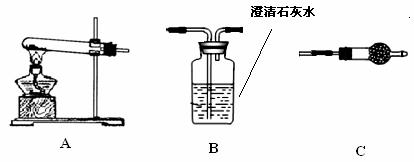

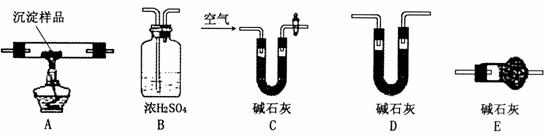
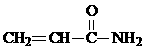
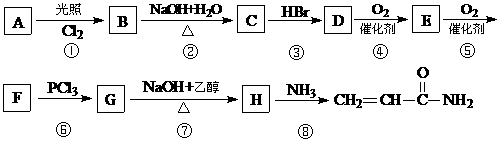
 3RCOCl+H3PO3
3RCOCl+H3PO3