11.下列肯定能达到目的的是 ( )
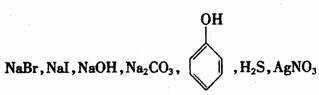 ①用一种试剂就能鉴别下列七瓶无色溶液:
①用一种试剂就能鉴别下列七瓶无色溶液:
②不用任何其他试剂可以鉴别下列四瓶无色溶液:
|
A.只有①能达到目的 B.只有②能达到目的
C.①②都达不到目的 D.①②都能达到目的
11.下列肯定能达到目的的是 ( )
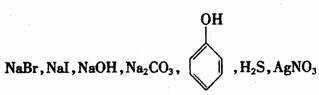 ①用一种试剂就能鉴别下列七瓶无色溶液:
①用一种试剂就能鉴别下列七瓶无色溶液:
②不用任何其他试剂可以鉴别下列四瓶无色溶液:
|
A.只有①能达到目的 B.只有②能达到目的
C.①②都达不到目的 D.①②都能达到目的