摘要:随材料科学的发展.金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5.VOSO4及不溶性残渣).科研人员最新研制了一种离子交换法回收钒的新工艺.回收率达91.7%以上.该工艺的主要流程如下: 部分钒的化合物在水中的溶解性如下表所示.由此回答下列问题: 物质 VOSO4 V2O5 NH4VO3 (VO2)2SO4 溶解性 可溶 难溶 难溶 易溶 (1)23V在元素周期表位于第 周期 族.工业上由V2O5 冶炼金属钒常用铝热剂法.其化学方程式为 . (2)反应①的目的是 . (3)测定反应②溶液中钒的含量.可用已知浓度的 酸化H2C2O4溶液滴定(VO2)2SO4溶液.主要产物为CO2 和VOSO4.其离子方程式为: . (4)已知NH4VO3在焙烧过程中150~200℃时先失 去氨,在300~350℃再失去水.请在右边座标图中画出 加热234g NH4VO3固体质量的减少值△W随温度(T) 变化的曲线.
网址:http://m.1010jiajiao.com/timu3_id_55113[举报]
随材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.该工艺的主要流程如图1:

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)反应①的目的是______.
(3)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,其离子方程式为:______.
(4)已知NH4VO3在焙烧过程中150~200℃时先失去氨;在300~350℃再失去水.请在右边座标图2中画出加热234g NH4VO3固体质量的减少值△W随温度(T)变化的曲线. 查看习题详情和答案>>
随材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.该工艺的主要流程如图1:

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
(1)23V在元素周期表位于第______周期______族.工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式为______.
(2)反应①的目的是______.
(3)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,其离子方程式为:______.
(4)已知NH4VO3在焙烧过程中150~200℃时先失去氨;在300~350℃再失去水.请在右边座标图2中画出加热234g NH4VO3固体质量的减少值△W随温度(T)变化的曲线.
查看习题详情和答案>>

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)反应①的目的是______.
(3)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,其离子方程式为:______.
(4)已知NH4VO3在焙烧过程中150~200℃时先失去氨;在300~350℃再失去水.请在右边座标图2中画出加热234g NH4VO3固体质量的减少值△W随温度(T)变化的曲线.
随材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.该工艺的主要流程如图1:

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
(1)23V在元素周期表位于第______周期______族.工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式为______ l6V+5Al2O3
查看习题详情和答案>>

部分钒的化合物在水中的溶解性如下表所示,由此回答下列问题:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.
部分含钒物质在水中的溶解性如下表所示:
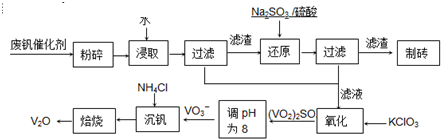
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图). 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.
根据图试建议控制氯化铵系数和温度: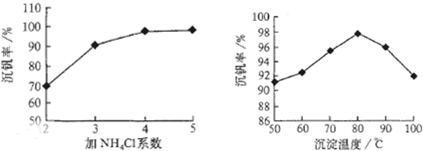
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示.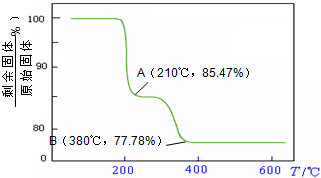 则NH4VO3在分解过程中
则NH4VO3在分解过程中
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
查看习题详情和答案>>
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
V2O5+SO32-+4H+=2VO2++SO42-+2H2O
V2O5+SO32-+4H+=2VO2++SO42-+2H2O
.(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图).
 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为SO2+V2O5?SO3+V2O4
SO2+V2O5?SO3+V2O4
,4VOSO4+O2?2V2O5+4SO3
4VOSO4+O2?2V2O5+4SO3
.(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.
根据图试建议控制氯化铵系数和温度:
4
4
、80℃
80℃
.
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示.
 则NH4VO3在分解过程中
则NH4VO3在分解过程中B
B
.A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是 (填序号)
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K= ;
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式: ;
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下: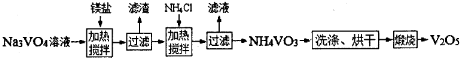
①加入镁盐,加热搅拌,其中加热的作用是 ;
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)= ;
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为 ;
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为 (用含m、a、b的代数式表示).
查看习题详情和答案>>
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K=
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式:
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下:

①加入镁盐,加热搅拌,其中加热的作用是
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)=
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为