网址:http://m.1010jiajiao.com/timu3_id_431861[举报]
(1)取样品①m1 g,加入过量NaOH溶液,充分反应后过滤;往滤液中通入过量CO2气体;将所得沉淀过滤、洗涤、烘干、灼烧,得到固体的质量仍然为m1 g.合金中镁的质量分数为
(2)取样品②m2 g,与足量稀硫酸反应,固体完全溶解时得到气体的体积为V L(标准状况).m2的取值范围是
(3)取样品③0.918g,与30.00mL、2.00mol/L盐酸充分反应后,得到672mL气体(标准状况),剩余合金0.306g.然后改加1.00mol/L的NaOH溶液,使剩余合金中的铝恰好完全溶解.需要加入1.00mol/L的NaOH溶液
(4)为了确定可能含有镁、铝元素的某未知硫酸盐晶体的化学式,称取67.80g晶体溶于水,向其中逐滴加入足量Ba(OH)2溶液后过滤,得到99.00g白色沉淀,用稀硝酸处理沉淀物,经洗涤和干燥,最终得到白色固体93.20g.试通过计算确定该晶体的化学式.(写出推算过程) 查看习题详情和答案>>
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
电池反应为FePO4+Li ![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
 (3)铁在元素周期表中的位置是 。
(3)铁在元素周期表中的位置是 。
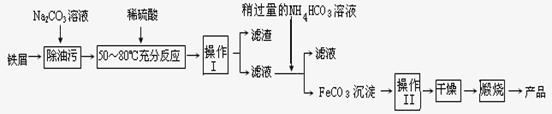
氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是____ 、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。 a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容; b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,
配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_______________。
②计算上述样品中FeSO4·7H2O的质量分数为
查看习题详情和答案>>铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。
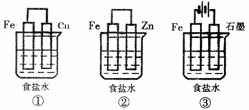
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为
。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为
FePO4+Li ![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
(3)铁在元素周期表中的位置是 。
氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
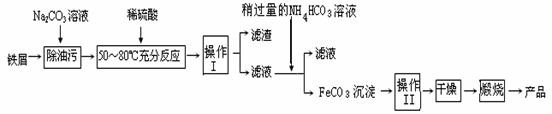
①操作Ⅰ、Ⅱ的名称分别是__ __ 、__ __。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,
配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_______________。
②计算上述样品中FeSO4·7H2O的质量分数为
查看习题详情和答案>>铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述
(填装置序号)装置原理进行防护;装置③中总反应的离予方程式为
。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
|
|
负极反应为Li-e-=Li+,则正极反应式为 。
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作I、Ⅱ的名称分别是 、 。
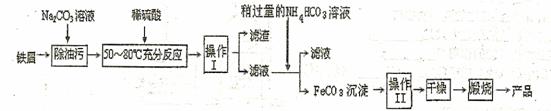
②写出在空气中锻烧FeCO3的化学方程式 ;
(4)有些同学认为![]() 溶液滴定也能进行铁元素含量的测定(
溶液滴定也能进行铁元素含量的测定(![]() )。
)。
a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/KMnO4溶液滴定至终点,消耗![]() 溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为
溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为
工业上以海水为原料可获得金属镁及其多种化合物.其中Mg(OH)2是制备镁盐、耐火材料和阻燃剂等的重要原料.已知:①25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12;
②Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ?mol-1.试回答下列问题:
(1)下列叙述正确的是______.(填字母序号)
A.从海水中获得Mg(OH)2工业上选择 NaOH作沉淀剂
B.Mg(OH)2能用作阻燃剂主要因为分解吸热且生成MgO覆盖可燃物
C.工业上由Mg(OH)2制金属镁的流程如下:

(2)已知酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(3)达喜是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐(可能带有结晶水).现进行如下实验确定化学式:
实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀.
①达喜中Mg2+与Al3+的物质的量之比为______.
②计算达喜的化学式,写出必要的计算过程. 查看习题详情和答案>>