网址:http://m.1010jiajiao.com/timu3_id_431869[举报]
硫、氮及其化合物与人类的生活有着密切关系
ⅠNO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO的危害在于______(填标号).
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式:______.
(3)已知NH3和Cl2会发生氧化还原反应,生成N2和NH4Cl.现用如图1所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
①写出实验室制取氨气的化学方程式______.
②试管内发生反应的化学方程式是______.
③试管中发生的反应表明氨气具有______ (填标号).
a、氧化性 b、还原性 c、碱性 d、热不稳定性

Ⅱ(1)将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则SO2在上述反应中的作用是______(填标号).
a.漂白剂 b.氧化剂 c.还原剂
(2)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用H2O2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式______.
(3)用上图2实验装置可以证明硫、碳、硅三种元素的非金属性强弱.则A、B、C所代表的物质的名称:A______,B______,C______填化学式).
查看习题详情和答案>>
(1)在常温下,碳酸和次氯酸的电离常数如下表所示。

(2)甲醇是目前推广车用燃料,该物质可用天然气(主要成分为CH4)合成。
2CH4(g)+O2(g)=2CO(g)+4H2(g) △H1=-71kJ/mol①
CO(g)+2H2(g)=CH3OH(l) △H2=-90.5 kJ/mol②
CH4(g)+O2(g)=CH3OH(l) △H3=_____kJ/mol。
表示该反应过程中的能量变化的曲线是____(选填如图中的序号“I~Ⅳ”)。

a.硫酸沸点高,属于非挥发性酸
b.硫酸具有氧化性
c.稀硫酸与碳酸钙反应生成微溶的CaSO4
d.稀硫酸与碳酸钙反应不能持续地产生二氧化碳
(4)燃料电池所用燃料为可燃性气体,例如以CO为燃料就可以制作原电池,这种电池的一个电极中通入O2,另一个电极中通入CO,电解质采用的是熔融碳酸盐,由此可知该燃料电池放电时的负极反应式为________,如果使用该电池电解饱和食盐水制取NaClO,那么理论上生成1mol NaClO需要标准状况下的氧气的体积为____L。
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂。査阅文献:过氧化钙的制备方法一般有两种方案。利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·8H2O沉淀。已知CaO2·8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2·2H2O,再在 140℃下烘0.5小时,得无水CaO2。加热至350℃左右开始分解放出氧气。
已知某化工厂生产过氧化钙的主要工艺流程如下:
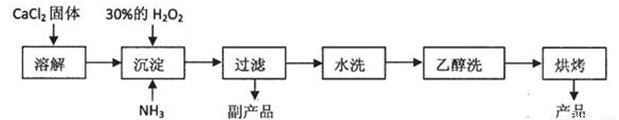
某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)
查看习题详情和答案>>
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂。査阅文献:过氧化钙的制备方法一般有两种方案。利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·8H2O沉淀。已知CaO2·8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2·2H2O,再在 140℃下烘0.5小时,得无水CaO2。加热至350℃左右开始分解放出氧气。
已知某化工厂生产过氧化钙的主要工艺流程如下: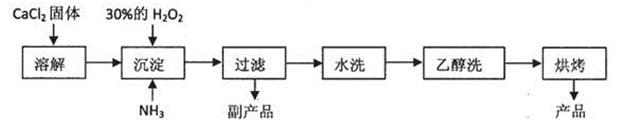
某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)
已知某化工厂生产过氧化钙的主要工艺流程如下:

某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)