25.(15分)
(1)在上面元素周期表p区中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族。
(3)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(4)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
M层上有2对成对电子 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
①Y位于元素周期表位置 ,Y和Z的最高价氧化物对应的水化物的酸性较强的
是 (写化学式)。
②XY2是一种常用的溶剂,请写出它的电子式 ,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 。
③Y有两种氧化物其化学式为YO2 和YO3 ,其中YO3中Y原子采用 杂化,YO2分子的空间构型 。
④W的基态原子核外电子排布式是 。现有含W2+的配合物,化学式为[W(H2O)4] SO4·H2O。该配合物中含有的化学键类型 ,该配合物的配体是 。
23.(16分)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
装置图:
正极反应 ,
负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
①通入足量氯气,目的 ;②加入CuO调节溶液的PH至 ;
③过滤除去 (填化学式)
|
|
氢氧化物开始沉淀时的PH |
氢氧化物沉淀完全时的PH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
编号 |
实验内容 |
实验操作 |
预期现象和结论 |
|
① |
检验黄色溶液A中是否含有Fe2+ |
|
|
|
② |
检验绿色溶液C中是否含有Fe3+ |
|
|
(5)电解过程中的阴极材料是 。
(6)采用排液法收集氯气,该液体是 ,原因 。
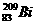 和
和 的说法正确的是 ( )
的说法正确的是 ( ) (1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是________(只写一种)。用有关离子方程式解释 B溶液显酸性的原因是:
。
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是________(只写一种)。用有关离子方程式解释 B溶液显酸性的原因是:
。
 CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示. 该反应过程中的能量变化如图2所示,
CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示. 该反应过程中的能量变化如图2所示,
 ①以H2为燃料可制成氢氧燃料电池。 已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
①以H2为燃料可制成氢氧燃料电池。 已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
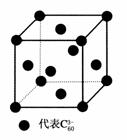 自1990年以来,对C60的研究报道很多,其中有碱金属K与C60在回流的甲苯中搅拌反应,得到碱金属化合物K3C60。其晶体是由K+和C所构成的离子晶体,如图是K3C60的一个晶胞结构图,其中仅标出了C在晶胞中的分布(为面心立方体),该晶胞中含K+数为 ( )
自1990年以来,对C60的研究报道很多,其中有碱金属K与C60在回流的甲苯中搅拌反应,得到碱金属化合物K3C60。其晶体是由K+和C所构成的离子晶体,如图是K3C60的一个晶胞结构图,其中仅标出了C在晶胞中的分布(为面心立方体),该晶胞中含K+数为 ( ) 可逆反应2A+B
可逆反应2A+B 2C(g);△H<0随T(℃)变化气体平均相对分子质量Mr的变化如图所示,则下列叙述中正确的是( )
2C(g);△H<0随T(℃)变化气体平均相对分子质量Mr的变化如图所示,则下列叙述中正确的是( )