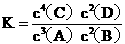20.(12分)运用化学反应原理可以更好的分析化学反应的本质 。
(1)下列四组物质反应,其中与其它三组有本质不同的是 。
A. Na2O2 + H2O B. F2 + H2O C. Cl2 + H2O D. NO2 + H2O
(2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成
沉淀 ( 填化学式 );当两种沉淀共存时溶液中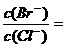 。
。
(已知 25℃时 Ksp(AgBr)=5.4×l0-13,Ksp(AgCl)=2.0×l 0-10)
(3) 汽车尾气净化中的一个反应如下:2N O(g)+2CO(g) 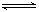 N2(g)+2CO2(g)
N2(g)+2CO2(g)
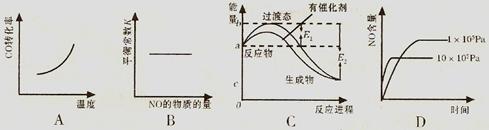
该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
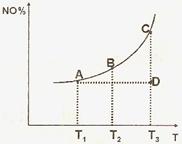
① 2NO(g)+2CO(g) 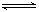 N2(g)+2CO2(g) 的△H ( 填 “>” 或 “<”)
N2(g)+2CO2(g) 的△H ( 填 “>” 或 “<”)
②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1__________K2; 若反应进行到状态 D 时,V正 V逆(填“>”、“<”或“=”)
③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是
(4)分析下表提供的数据:
|
化学式 |
电离常数 |
|
HClO |
Ki=3×10-8 |
|
H2CO3 |
Ki1=4.3×10-7 |
|
Ki2=5.6×10-11 |
① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式: ; 。
②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序: 。
18. (15分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为 ;元素T在周期表中位于周期表 ;J和R的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为 。
(3)L的最简单气态氢化物甲的水溶液显碱性。
一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是____ ___(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(4)R所在族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
(5)处理含JO、RO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质R。
已知:JO(g)+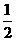 O2(g) = JO2(g)
O2(g) = JO2(g) 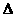 H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
R(g)+ O2(g) = RO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
(6)某元素与R元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
17.(15分)Ⅰ:下列有关实验的描述不正确的是 (填序号);
①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。
② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。
⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液
⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的方程式) 。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 ,写出发生反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3。实验小组设计如下方案:
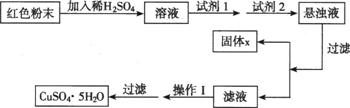
试回答: ①试剂1为 ,试剂2为 (填字母)。
②固体X的化学式为 。 ③操作I为 。
 C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为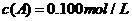 、
、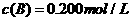 及
及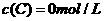 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。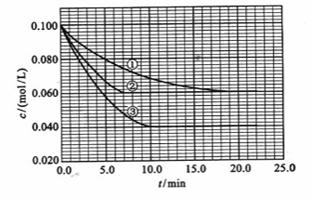
 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;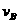 =______________________;实验③:
=______________________;实验③: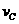 =_________________________。
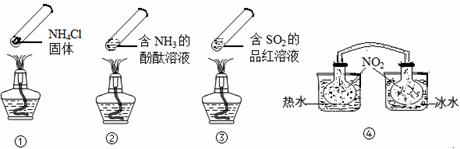
=_________________________。
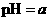 ,将此溶液稀释10倍后,溶液的
,将此溶液稀释10倍后,溶液的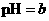 ,则b + 1= a
,则b + 1= a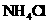 至溶液恰好无色,则此时溶液的pH = 7
至溶液恰好无色,则此时溶液的pH = 7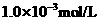 醋酸的
醋酸的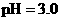 ,
,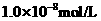 盐酸的pH小于7且接近7
盐酸的pH小于7且接近7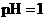 的盐酸与100mL
的盐酸与100mL 溶液混合后,溶液的
溶液混合后,溶液的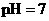 则
则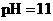
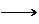 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化