网址:http://m.1010jiajiao.com/timu3_id_430546[举报]
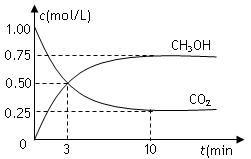
在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是

A.从反应开始到平衡,氢气的平均反应速率为0.225mol/(L·min)
B.图中交点表示反应达到化学平衡状态
C.升高温度,n(CH3OH)/n(CO2)减小
D.10分钟后向容器再充入1mol CO2和3mol H2,重新达平衡后,CO2体积分数将增大
查看习题详情和答案>>
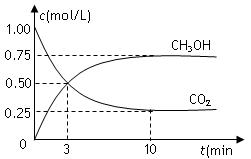
在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
A.从反应开始到平衡,氢气的平均反应速率为0.225mol/(L·min)
B.图中交点表示反应达到化学平衡状态
C.升高温度,n(CH3OH)/n(CO2)减小
D.10分钟后向容器再充入1mol CO2和3mol H2,重新达平衡后,CO2体积分数将增大
查看习题详情和答案>>在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
A.从反应开始到平衡,氢气的平均反应速率为0.225mol/(L·min)
B.图中交点表示反应达到化学平衡状态
C.升高温度,n(CH3OH)/n(CO2)减小
D.10分钟后向容器再充入1mol CO2和3mol H2,重新达平衡后,CO2体积分数将增大
查看习题详情和答案>>
在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是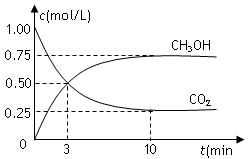
| A.从反应开始到平衡,氢气的平均反应速率为0.225mol/(L·min) |
| B.图中交点表示反应达到化学平衡状态 |
| C.升高温度,n(CH3OH)/n(CO2)减小 |
| D.10分钟后向容器再充入1mol CO2和3mol H2,重新达平衡后,CO2体积分数将增大 |
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是