18.(12分)室温下,水溶液体系中的化学反应I- + OCl- = OI- + Cl-的反应物初始浓度、溶液中的OH-初始浓度及初始速率间的关系如下表所示:
|
实验 编号 |
I-的初始浓度 (mol·L-1) |
OCl-的初始浓度 (mol·L-1) |
OH-的初始浓度 (mol·L-1) |
初始速率v (mol·L-1· s-1) |
|
1 |
2 × 10–3 |
1.5 × 10–3 |
1.00 |
1.8 × 10–4 |
|
2 |
a |
1.5 × 10–3 |
1.00 |
3.6 × 10–4 |
|
3 |
2 × 10–3 |
3 × 10–3 |
2.00 |
1.8 × 10–4 |
|
4 |
4 × 10–3 |
3 × 10–3 |
1.00 |
7.2  × 10–4 × 10–4 |
已 知表中初始反应速率与有关离子浓度关系可以表示为v= k [I-]1 [OCl-]b [OH-]c(温度一定时,k为常数)。
知表中初始反应速率与有关离子浓度关系可以表示为v= k [I-]1 [OCl-]b [OH-]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ;
(2)实验2中,a= ;
(3)设计实验2和实验4的目的是 ;
(4)计算b、c值:b=
;c =
;
=
;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
17.(12分)部分短周期元素的原子半径及常见化合价如下表:
|
元素代号 |
Z |
M |
Q |
R |
T |
X |
|
原子半径/nm |
0.077 |
0.130 |
0.111 |
0.099 |
0.073 |
0.102 |
|
常见化合价 |
+4 ,-4 |
+2 |
+4 ,-4 |
-1,+7 |
-2 |
+6,-2 |
根据要求回答问题(如需填化学用语的,请用各元素的元素符号表示)
(1) X元素在元素周期表的位置是 。
(2) R的气态氢化物比X的气态氢化物
 (填稳定或不稳定)。
(填稳定或不稳定)。
(3)写出M的单质与ZT2反应的化学方程式 。
(4)Q的最高价氧化物在现代通信的重要用途是 。
(5)己知XO2在500℃,1大气压下被氧气氧化,每生成1 mol气态XO3,放出98.3 kJ热量,该反应的热化学方程式是
(6)工业上用Z的单质与水蒸汽反应制水煤气,则该反应的平衡常数表达式K= 。
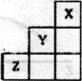
 1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→
→
→
→
1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→
→
→
→