21.(10分)A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如下表所示:
|
元素 |
结构或性质 |
|
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
|
B |
二价阳离子与Ne原子具有相同的电子层结构 |
|
C |
形成化合物种类最多的元素之一,其单质为固体 |
|
D |
地壳中含量最多的元素 |
|
E |
与D同主族 |
|
F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作印刷电路铜板,反应的离子方程式为:
.
(2)CD2分子中化学键的类型是 ;
其与上述某元素形成的物质发生置换反应的化学方程式是 .
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为 .
(4)由B、D两种元素形成的化合物的电子式为 .
19.(8分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 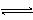 2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2变化曲线的是 .用O2表示从0 s-2
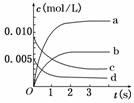 内该反应的平均速率v= . mol/(L·s)
内该反应的平均速率v= . mol/(L·s)
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是 .
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
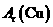 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算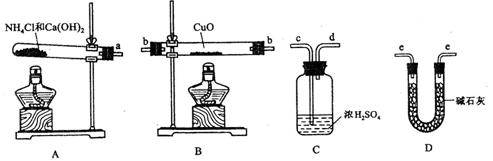
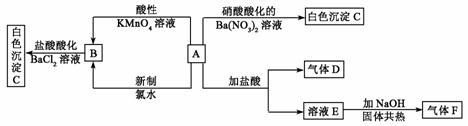
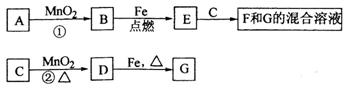 (10分)A-G各物质间的关系如下图,其中B、D为气态单质。
(10分)A-G各物质间的关系如下图,其中B、D为气态单质。 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2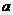 mol钠和
mol钠和 g足量水中,所得溶液密度为
g足量水中,所得溶液密度为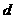 g·mL-1,该溶液中溶质质量分数为 ( )
g·mL-1,该溶液中溶质质量分数为 ( )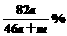 B.
B. % C.
% C.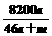 % D.
% D.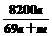 %
%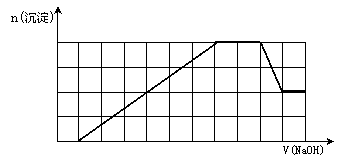 D.反应最后形成的溶液中含有的溶质为Na2SO4
D.反应最后形成的溶液中含有的溶质为Na2SO4