网址:http://m.1010jiajiao.com/timu3_id_398196[举报]
(1)氢气燃烧热值高.实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9kJ热量.则H2燃烧的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.

图中t1时引起平衡移动的条件可能是
②温度为T℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
(1)氢气燃烧热值高.实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9kJ热量.则H2燃烧的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景.现氢氧燃料电池进行图1所示实验:

①氢氧燃料电池中,正极的电极反应式为
②右图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图2所示.图2中t1时引起平衡移动的条件可能是
②若在恒温、恒压条件下向平衡体系中通入氩气,平衡
温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
(1)氢气燃烧热值高。实验测得,在常温常压下,
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,正极的电极反应式为__________________________________________

②上图装置中,某一铜电极的质量减轻
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ/mol
2NH3(g)ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是___________________其中表示平衡混合物中NH3的含量最高的一段时间是_________________。②温度为T℃时,将
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是
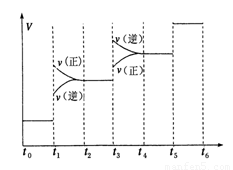
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
查看习题详情和答案>>
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是 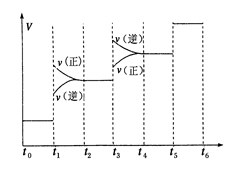
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为