18.(12分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是___________________。
 (2)氢硒酸放在空气中长期保存易变质,其可能发生的化学方程式为______________________________。
(2)氢硒酸放在空气中长期保存易变质,其可能发生的化学方程式为______________________________。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:____A12Te3+____( )一___A1(OH)3↓+_____H2Te↑
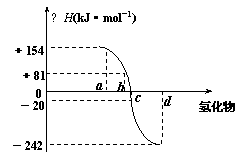
(4)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
①写出氧族元素中含有18e-的两种氢化物的电子式 。
②请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
③写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
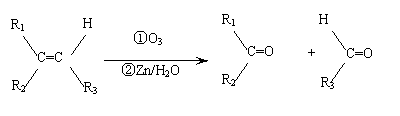 (10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
(10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
 ① □MnO4-+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4-+□H2O2+□H+
□Mn2++□O2十□H2O ② H2O2+2
② H2O2+2 +2H+
I2+2H2O
+2H+
I2+2H2O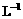 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。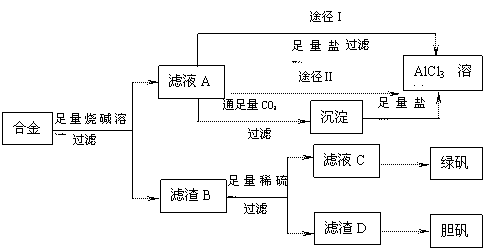

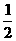 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)