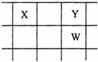
22.(11分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示:
|
(2)这五种元素中,原子半径最大的是 (填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是 (用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为 (用化学式表示);
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式 ;
(4)写出由W所在主族元素形成的含有18e-的四原子氢化物的电子式 ;
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9g该化合物燃烧生成XY2和液态H2Y时,放出140kJ的热。写出该化合物燃烧热的热化学方程式:
。
19.(11分)分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
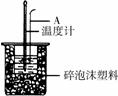 (2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的 (填“偏大”、“偏小”或“无影响”);
(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)__________;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热 =____________________;
=____________________;
(5) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
|
|
|
4CuO======2Cu2O+O2 2SO3 2SO2 + O2
取一定量硫酸铜晶体(CuSO4·XH2O)置于已知质量的坩埚中称重,测得硫酸铜晶体的质量为ag。用酒精灯将坩埚充分加热,然后放入干燥器中冷却,再称重。经若干次加热、
班级 姓名 学号
冷却称重,直到质量基本不变,称得坩埚中剩余固体物质的质量为bg。
(1)在上述实验操作中,至少称量 次。
(2)该晶体中x的实验值为________________________________________。
(3)将实验值与根据化学式(CuSO4·5H2O)计算的结果比较,实验值大于计算值,造成误差的原因可能是____________________。
a.实验中部分固体溅出 b.加热温度过高
c.部分样品已风化 d.硫酸铜晶体中含有不挥发性杂质
(4)另取25.0g胆矾(CuSO4·5H2O),缓慢升温到1000℃,
①在加热过程中,当固体物质的质量为10.0g时,该固体可能的组成是(用化学式表示)___________________________。
②在1000℃时,除水外,其余气态产物物质的量(n)的取值范围是(不考虑实 验误差)___________________________________________。
 2HI(g);
2HI(g);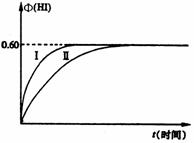 (1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。
(1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。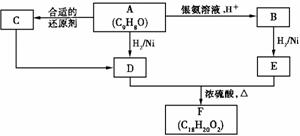
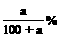 B.n (NaCl)=
B.n (NaCl)=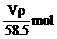
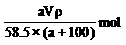 D.c (NaCl)=
D.c (NaCl)=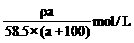
 MgxMo3S4
x Mg + Mo3S4
MgxMo3S4
x Mg + Mo3S4