25.(6分)化学反应常伴随热量变化,即反应热。反应热分为燃烧热、中和热、沉淀热等多
种形式。中和热测定提供了一种测定反应热的方法,是一个重要的定量实验。该实验步骤为:①制作量热计;②量取50mL 0.50mol/L盐酸并测定初始温度;③量取50mL 0.50mol/L NaOH溶液并测定初始温度;④混合酸碱溶液,搅拌,测混合液最高温度;⑤重复②③④三步骤;⑥数据处理:计算中和热。(中和后生成的溶液的比热容C=4.18J·g-1·℃-1,溶液密度为1g/mL)某学生做此实验数据如下:
|
实验次数 |
初始温度t1/℃ |
混合液最高温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
19.9 |
20.0 |
23.5 |
|
2 |
20.0 |
20.1 |
23.7 |
(1)计算中和热△H= 。
(2)中和热的理论值为△H=-57.3kJ/mol,造成该实验误差的原因可能是
A.小烧杯口高于大烧杯口 B.整个过程动作慢了
C.用环形铁制搅拌棒代替玻璃搅拌棒 D.可能存在稀释热
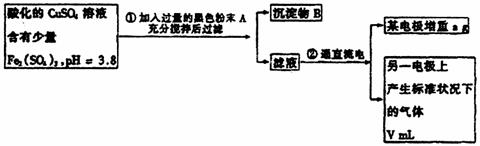 26.(15分)已知pH为4-5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量,其实验流程如下图所示:
26.(15分)已知pH为4-5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量,其实验流程如下图所示:
试回答下列问题:
(1)步骤①所加入的A的化学式及加入A的作用是 (填字母);
a. Fe2O3;抑制Fe3+水解
b. CuO;与H+反应,调节溶液pH在4-5间使Fe3+完全水解
 c.
CuO;与Fe2(SO4)3发生氧化还原反应
c.
CuO;与Fe2(SO4)3发生氧化还原反应
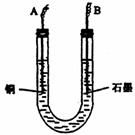
(2)步骤②中所用部分仪器如图所示:则A应接直流电源
的 极。B电极上发生的电极反应式为
。
(3)在确定电极质量增生a g的操作中,下列实验操作属于不
必要的是 (填字母)。
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.低温烘干电极后称量
E.再次低温烘干后称量至恒重
(4)电解后向溶液中加入石蕊试液,观察到的现象是 。
(5)铜的相对质量的计算式为 。
(6)步骤②的变化中,从能量转化的角度看是 能转化为 能。
23.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温氮气流中,通
|
SiO2+ C+ N2 Si3N4+ CO
(1)配平上述方程式。
(2)该反应的氧化剂是 (填化学式);被1mol氧化剂氧化的还原剂的物质的量为 mol。
(3)氮化硅硬度大,熔点高,属于 (填晶体类型)晶体;将下列物质熔点由高到低排序:①单晶硅;②N2;③氮化硅;④C60 (填序号)。
 4NO(g)+6H2O(g)
,下列叙述正确的是
4NO(g)+6H2O(g)
,下列叙述正确的是