22、(1)下表列有四种物质的沸点
|
物质 |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
沸点/℃ |
1465 |
1412 |
181(升华) |
57.6 |
①从表中的数据,结合学过的化学知识,你能得到的规律是 。
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
(1)①第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。(2分) ②SiCl4、AlCl3(2分) ③ ﹥(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③ ﹤(1分)
20、某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
5 Fe2+ +5C2O42-+3MnO4-+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
|
a/g |
起始读数/mL |
b/mL |
c/mL |
|
0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42-)== ;
FeC2O4 的质量分数为 (精确到0.01%)
(1)重复以上实验1-2次(2分)
(2)用高锰酸钾标准溶液润洗滴定管(2分)
(3)KSCN(1分),溶液中没有出现血红色(1分)
(4)n(Fe2+)==0.001110mol(1分) n(C2O42-)==0.001010mol(1分)
FeC2O4 的质量分数为73.81%(2分)
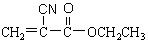 ),请写出“502胶”发生粘合作用的化学方程式:
),请写出“502胶”发生粘合作用的化学方程式: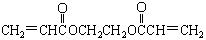 )也是一种粘合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为
)也是一种粘合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为 。已知含有
。已知含有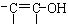 结构的物质不能稳定存在。请另外任写其3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
;
结构的物质不能稳定存在。请另外任写其3种含-CH=CH-结构的链状同分异构体的结构简式:
、
、
;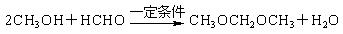 ,聚乙烯醇
,聚乙烯醇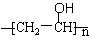 可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式: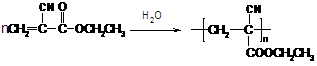 (2分)
(2分)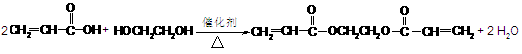 (2分)
(2分)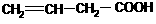 、
、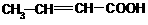 、CH2=CHCH(OH)CHO
(3分,各1 分,合理则给分)
、CH2=CHCH(OH)CHO
(3分,各1 分,合理则给分)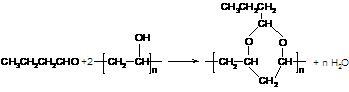 (3分)
(3分)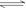 如右图所示,一定条件下将1mol
A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平
如右图所示,一定条件下将1mol
A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平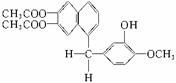 鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右: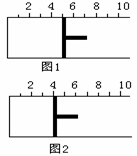
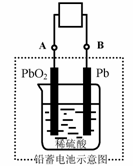 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O, PbSO4
PbSO4