28. (14分) a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1) e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)______________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为_________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)______________________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
姓名 座号 班别
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
21
22(1) (2)
(3)
(4)
(5)
27、(14分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是___________。
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
24、(6分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
|
粒子代号 |
A |
B |
C |
D |
E |
F |
G |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C常用作F的检验(加热)。请填写下列空白:
(1) A粒子的结构示意图 。
(2) 比较BC和EC2的碱性强弱BC EC2(填< 、> 、= )。
(3) F与C反应的离子方程式
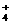 )增大的是____________;(b)能使C(OH-)增大,使C(NH
)增大的是____________;(b)能使C(OH-)增大,使C(NH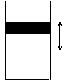 在如图所示的三个容积相同的容器①、②、③中进行如下的反应:
在如图所示的三个容积相同的容器①、②、③中进行如下的反应: 3A(g)+B(g)
3A(g)+B(g) 2C(g) △H<0.
2C(g) △H<0.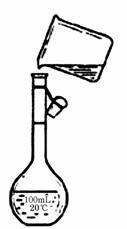 (1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。