20.在反应SiO2+3C SiC+2CO中,氧化剂和还原剂物质的量之比是 ( )
A.1:3 B.3:1 C.1:2 D.3:1
第Ⅱ卷(非选择题,共60分)
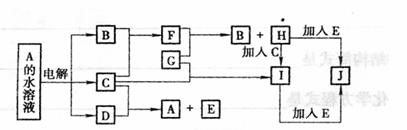 21.(12分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8,比A的总数少18。请填写下列空格:
21.(12分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8,比A的总数少18。请填写下列空格:
(1)E是 ,I是 ,I溶液蒸干灼烧得 (均填化学式)。
(2)写出C的水溶液与SO2反应的离子方程式 ,
(3)写出I+E→J在水溶液中反应的离子方程式 ,
|
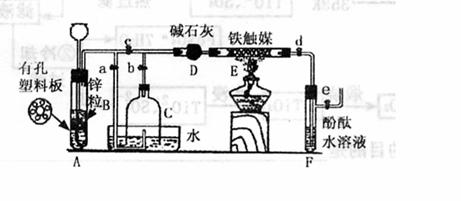 22.(14分)某化学小组在实验室模拟工业生产制备少量氨气,他们设计如下图所示装置(图中夹持装置均已略去)
22.(14分)某化学小组在实验室模拟工业生产制备少量氨气,他们设计如下图所示装置(图中夹持装置均已略去)
[实验操作]①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸,则A中有氢气生成。打开弹簧夹c、d、e,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内液面下降到保持不变时,找开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内液面下降到保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大;此时再打开弹簧夹b的主要目的是 。
(3)在步骤③反应完成后,如果验证反应后的气体中还含有H2、N2?
|
13.溴化碘的分子式IBr,它的化学性质活泼,能与大多数金属反应,其与H2O反应的化学方程式为:IBr+H2O=HBr+HIO。下列叙述不正确的是 ( )
A.溴化碘为共价化合物
|
C.IBr与水的反应为非氧化还原反应
D.在化学反应中,IBr可以作为氧化剂




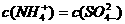 B.
B.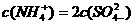
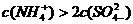 D.
D.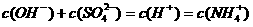
 15.右图是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子,该物质不具有的性质是 ( )
15.右图是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子,该物质不具有的性质是 ( )