15.02+15.95)mL=15.24mL。试分析他的计算是否合理,如果不合理请说明理由。
____________________________________________________________________。
⑵乙同学用0.1000mol / LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表。
|
V(NaOH)/mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
|
溶液pH |
2.88 |
4.70 |
5.70 |
6.74 |
7.74 |
8.72 |
9.70 |
10.70 |
11.70 |
 ①请作出pH-V(NaOH)图。
①请作出pH-V(NaOH)图。
②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为____________。所以可选择____________作指示剂。
附:常见指示剂的变色范围
|
指示剂 |
变色的范围(pH) |
|
甲基橙 |
3.1-4.4 |
|
石蕊 |
5.0-8.0 |
|
酚酞 |
8.2-10.0 |
17.某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol / LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液。)
Ⅰ.实验步骤:
⑴用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液。
⑵用酸式滴定管取待测食醋溶液20.00mL于 中。
⑶盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
⑷滴定,并记录NaOH的终读数。重复滴定2-3次。
Ⅱ.实验记录及数据处理
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)/mL(初读数) |
0.00 |
0.200 |
0.10 |
0.00 |
|
V(NaOH)/mL(终读数) |
14.98 |
15.20 |
15.12 |
15.95 |
|
V(NaOH)/mL(消耗) |
14.98 |
15.00 |
15.02 |
15.95 |
则c(样品)/ moL·L-1= ;样品总酸量g / 100mL= 。
Ⅲ.交流与讨论:
⑴甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+
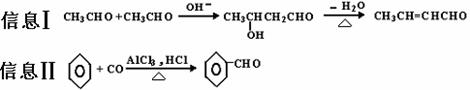
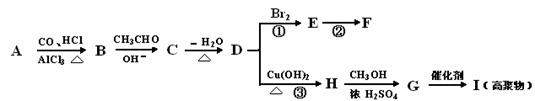
 (3)以苯、丙醛为原料,其他无机试剂任选,写出制备化合物
(3)以苯、丙醛为原料,其他无机试剂任选,写出制备化合物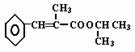 的合理流程图,注明试剂和条件。
的合理流程图,注明试剂和条件。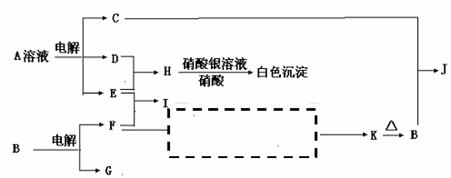

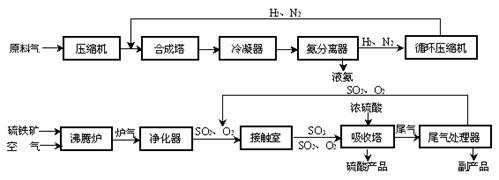
 2NH3(g);△H<0 …………①
2NH3(g);△H<0 …………① 表1:
表2:
表1:
表2: