23.(6分)下列有关实验的叙述,正确的是(填序号)
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
(C)金属锂应存放在煤油中防止被氧化
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)NaOH固体可长期保存在玻璃瓶中
(F)常温下铜跟稀硫酸不反应,跟浓硫酸能立即反应。
(G)除去乙酸中混有的乙醇:向混合液中加入生石灰后蒸馏
(H)使用石蕊试纸(检验气体)的第一步操作是把试纸用蒸馏水湿润
(J)在氢氧化铁胶体中加注少量硫酸会产生沉淀
(K)铜丝在氯气中燃烧实验必须先将铜丝加热,再伸入到氯气中,而铜丝在硫蒸气中燃烧,铜丝不需加热就可伸入到硫蒸气中。
(L)用结晶法可以除去氯化钠中混有少量硝酸钾
(M)要探究纯碱溶液呈碱性是由CO32-引起的,可向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱呈碱性是由CO32-引起的。
(N) 在试管中制备取氢氧化亚铁时,将吸有氢氧化钠的滴管插入硫酸亚铁溶液液面下,挤出滴管中的液体,滴管取出后立即用水将其洗净;
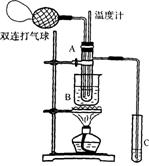 24.乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。
24.乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。
依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、
氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60-80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
|
物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
|
沸点/℃ |
20.8 |
117.9 |
290 |
197.2 |
100 |
请回答下列问题:
(1)试管A内在60℃-80℃时发生的主要反应的化学方程式为(注明反应条件):
______________________________________________________________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在________________________________;当试管A内的主要反应完成后温度计水银球的位置应在________________________________________,目的是_______________________________________________________________。
(3)烧杯B的作用是__________________________________________________________;烧杯B内盛装的液体可以是 _______________(在上表中选择,写出一种即可)。
(4)若想检验试管C中是否含产物乙酸,请你在所提供的药品中选择,设计一个简便的实验方案。
所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。
实验仪器任选。
该方案为:______________________________________________
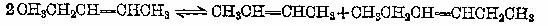
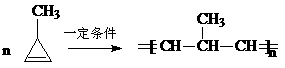

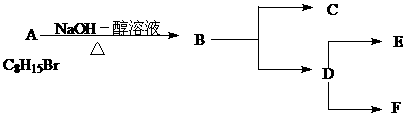
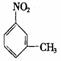 的同分异构体,要求苯环上有二个取代基且取代其位于对位______、_______、___________、_______________、___________、 。(可不填满也可补充);写出这些异构体中含有的官能团的名称(任写其中二种)___________,____________。
的同分异构体,要求苯环上有二个取代基且取代其位于对位______、_______、___________、_______________、___________、 。(可不填满也可补充);写出这些异构体中含有的官能团的名称(任写其中二种)___________,____________。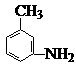 的所有原子 (填“是”或“不是”)在同一平面上,它的苯环上的一氯代物有________种同分异构体。写出它与盐酸反应的方程式____________________________________________。
的所有原子 (填“是”或“不是”)在同一平面上,它的苯环上的一氯代物有________种同分异构体。写出它与盐酸反应的方程式____________________________________________。 的电极名称是
;
的电极名称是
;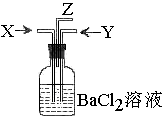 气瓶中产生的沉淀是碳酸钡
气瓶中产生的沉淀是碳酸钡