21.(9分)在一固定容积的密闭容器中,进行如下化学反应:
 CO2(g)+H2(g)
CO(g)+H2O(g);△H=QkJ·mol-1
CO2(g)+H2(g)
CO(g)+H2O(g);△H=QkJ·mol-1
其化学平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)上述反应中Q 0(选填“>”或 “<”);
(2)参判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.反应热△H不变
c.v正(H2)=v逆(CO) d.CO2的质量分数不变
 (3)温度为850℃时,可逆反应CO2(g)+H2(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
(3)温度为850℃时,可逆反应CO2(g)+H2(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
|
时间(min) |
CO |
H2O |
CO2 |
H2O |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3min时(CO浓度)c1= mol/L,H2O(g)的转化率为 。
②反应在4min-5min之间,平衡向逆方移动,可能的原因是 (单选),表中5min-6min之间数值发生变化,可能是原因是 (单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
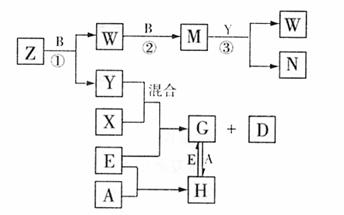 22.(9分)A、B、C、D、E、是五种常见的单质,A、B、C、D在常温下均为气体,其中,C是空气中含量最多的,D是所有气体中密度最小的;D能分别跟A、B、C在一定条件下化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关转化关系如图所示(反应条件均已略去)。
22.(9分)A、B、C、D、E、是五种常见的单质,A、B、C、D在常温下均为气体,其中,C是空气中含量最多的,D是所有气体中密度最小的;D能分别跟A、B、C在一定条件下化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关转化关系如图所示(反应条件均已略去)。
回答下列问题:
(1)A的化学式为 ,G的化学式为 ;
(2) 反应①的化学方程式为 ;
(3)过量E与N的稀溶液反应的离子方程式为 ;
(4)若将2.8g单质E与50mL 3mol·L-1N的溶液反应,生成溶液中溶质的成分是 ,其中物质的量之比为 。
20.(8分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A与D同主族,B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;E元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁、戊的组成如下表所示:
|
化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
|
分子式 |
A2C |
A2C2 |
B2A2 |
D2C2 |
DE |
回答下列问题:
(1)化合物丁中存在的化学键类型是 ;
(2)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为
NA(NA代表阿伏加德罗常数的值);
(3)用铁作阴极、石墨作阳极,电解甲、戊的混合物,电解反应的离子方程式为:
;
(4)2.0g丙完全燃烧,生成液态甲和B的气态氧化物,放出99.9kJ的热量,此燃烧反应的热化学方程式为 。
15.经测定,某溶液中只含有NH4+、C1-、H+、OH-四种离子。下列说法错误的是 ( )
A.溶液中四种离子之间可能满足:[C1-]>[H+]>[NH4+]>[OH-]
B.若溶液中的溶质是NH4C1和NH3·H2O,则[NH4+]>[C1-]>[NH3·H2O] >[H+]可
能成立
C.若溶液中四种离子满足:[C1-]>[NH4+]>[H+]>[OH-],则溶液中有溶质一定只有
|
D.若溶液中[C1-]=[NH4+],则该溶液一定呈中性
第Ⅱ卷(非选择题,共60分)
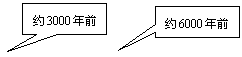
 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 (
)
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 (
)
 C.金属的化合价高低 D.金属的活动性大小
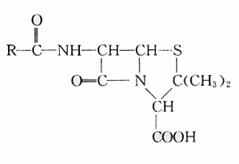
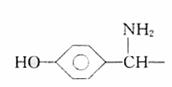
C.金属的化合价高低 D.金属的活动性大小 18.(12分)某链状聚酯G(聚合度为n)常被用作外科手术缝合线和骨科手术固定膜,手术后能在定期内被人体分解吸收。其合成路线如下:
18.(12分)某链状聚酯G(聚合度为n)常被用作外科手术缝合线和骨科手术固定膜,手术后能在定期内被人体分解吸收。其合成路线如下: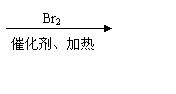
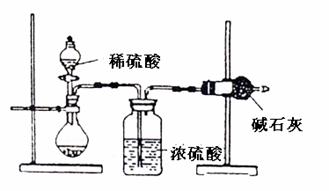 19.(8分)一般测定样品中成分含量的实验应重重2-3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
19.(8分)一般测定样品中成分含量的实验应重重2-3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案: