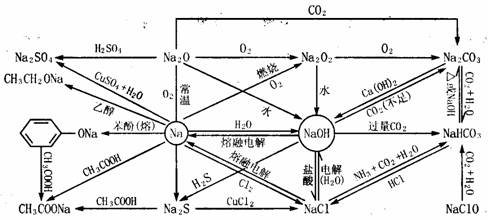
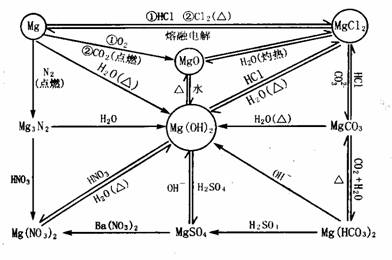
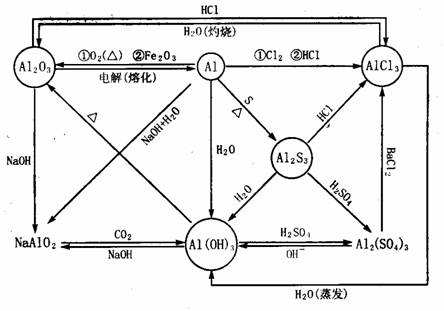
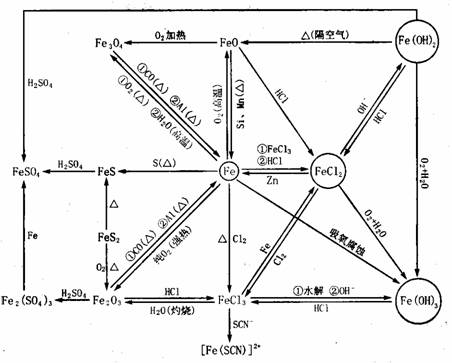
0 37456 37464 37470 37474 37480 37482 37486 37492 37494 37500 37506 37510 37512 37516 37522 37524 37530 37534 37536 37540 37542 37546 37548 37550 37551 37552 37554 37555 37556 37558 37560 37564 37566 37570 37572 37576 37582 37584 37590 37594 37596 37600 37606 37612 37614 37620 37624 37626 37632 37636 37642 37650 447348
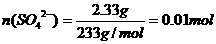
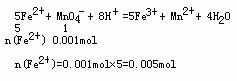
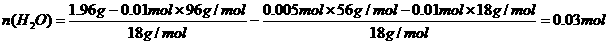 得n(NH4+): n(Fe2+): n(SO42-):n(H2O)=2:1:2:6
得n(NH4+): n(Fe2+): n(SO42-):n(H2O)=2:1:2:6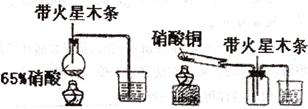 (8分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由子实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
(8分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由子实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):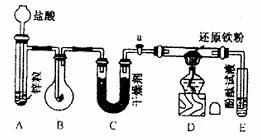 (8分)有实验装置图(见下图)
示意图中A是简易的氢气发生器、B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,产生氢气。经必要的“操作”(见问题(2))后,在导管出门处点燃氢气、然后如图所示套上烧瓶B,塞紧瓶赛,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色:
(8分)有实验装置图(见下图)
示意图中A是简易的氢气发生器、B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,产生氢气。经必要的“操作”(见问题(2))后,在导管出门处点燃氢气、然后如图所示套上烧瓶B,塞紧瓶赛,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色: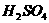 及
及 的条件下生成的三聚物;E是一种能使血红蛋白中毒的气体;F是D的钠盐;G是两分子F脱去一分子氢的缩合产物。
的条件下生成的三聚物;E是一种能使血红蛋白中毒的气体;F是D的钠盐;G是两分子F脱去一分子氢的缩合产物。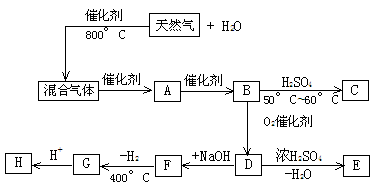
 C ______________________;A与H按物质的量比为2 : 1完全反应:______________________。
C ______________________;A与H按物质的量比为2 : 1完全反应:______________________。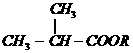

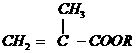
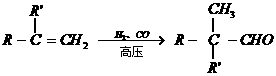
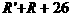 分子量:
分子量: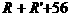
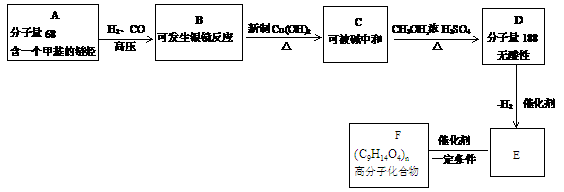 (1)写出化合物A、E、F的结构简式:
(1)写出化合物A、E、F的结构简式: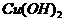 悬浊液反应的化学方程式:_________________。
悬浊液反应的化学方程式:_________________。