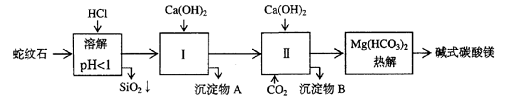
24(12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
⑴蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
⑵进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
⑶从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
⑷物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_________ (填写物质化学式)。
⑸现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③ ④ ⑤MgO称量
⑹18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:a=_________ b =_________ C =_________
25(10分)
⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
。
 ⑵肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式是
⑵肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式是
。
负极的电极反应式是
。
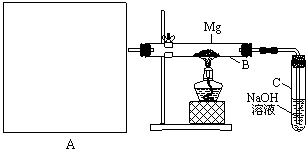
⑶右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,
则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设
空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式
26(8分)已知氯化铝的熔点为190℃(2.5×105Pa),但它在180℃时即开始升华。
(1)氯化铝是 。(填序号 ①离子化合物 ②共价化合物)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是
(4)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是
 W+Z,在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间。下列有关X、Y、Z、W的状态叙述正确的是
W+Z,在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间。下列有关X、Y、Z、W的状态叙述正确的是 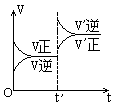 B.X、Y为气体,W、Z中有一种是气体
B.X、Y为气体,W、Z中有一种是气体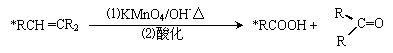 27(12分)碳碳双键有如下的断裂方式:
27(12分)碳碳双键有如下的断裂方式:
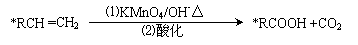
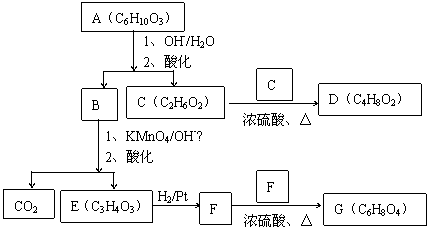
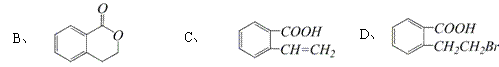 28(8分)有机物A的结构简式是
28(8分)有机物A的结构简式是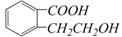 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
 23(16分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
23(16分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。 2C,产物C的生成情况如右图所示,a为40 MPa ,b为20 MPa时的情况,c为20MPa时从时间
2C,产物C的生成情况如右图所示,a为40 MPa ,b为20 MPa时的情况,c为20MPa时从时间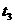 开始降低容器的温度情况,下列情况能满足图像变化,叙述正确的是
( )A、A、B、C均为气体,正反应吸热
开始降低容器的温度情况,下列情况能满足图像变化,叙述正确的是
( )A、A、B、C均为气体,正反应吸热