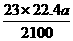6、(2005年丰台检测)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol/L AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为__________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于__________;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
|
剩余固体的组成 |
m的取值范围 |
n的取值范围 |
|
只有铜 |
|
|
|
有铁且有铜 |
|
(用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为_______mol/L。
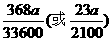 (3)
(3)