网址:http://m.1010jiajiao.com/timu3_id_375538[举报]
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


(3)B的电子式为
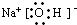
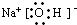


(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
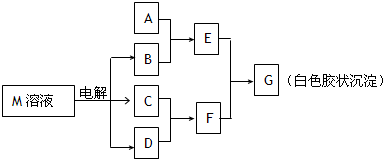
(7分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下图(部分产物已略去):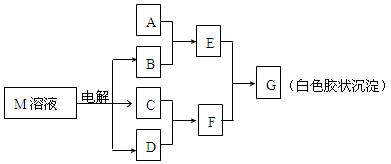
(1)工业电解M溶液的化学方程式为 。
(2)若A是X、Y同周期的一种常见金属,写出A与B溶液反应的化学方程式是 。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为 ,写出E与F反应的离子方程式是 。
(4)B的电子式为:_______ ___,其中的化学键类型为:______________。
___,其中的化学键类型为:______________。
(5)说明M物质的一种用途:___________ ______。
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式??????????????????????? 。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是????????????????? 。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是??????????????? 。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是?????????????????????????????????? 。
(5)若A是一种溶液,只可能含有 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为????????? 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为????????? 。

查看习题详情和答案>>
(7分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下图(部分产物已略去):
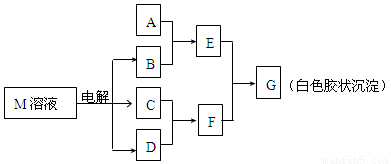
(1)工业电解M溶液的化学方程式为 。
(2)若A是X、Y同周期的一种常见金属,写出A与B溶液反应的化学方程式是 。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为 ,写出E与F反应的离子方程式是 。
(4)B的电子式为:__________,其中的化学键类型为:______________。
(5)说明M物质的一种用途:___________ ______。
查看习题详情和答案>>
(7分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下图(部分产物已略去):
(1)工业电解M溶液的化学方程式为 。
(2)若A是X、Y同周期的一种常见金属,写出A与B溶液反应的化学方程式是 。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为 ,写出E与F反应的离子方程式是 。
(4)B的电子式为:__________,其中的化学键类型为:______________。
(5)说明M物质的一种用途:___________ ______。
查看习题详情和答案>>