(三)碱金属的相似性、递变性
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
区分碱金属投入水中产生现象的异同:
现象: Li Na K Ru、Cs

共同点 浮、熔、游、
气、 红(酚酞) 沉
不同点: 不熔 熔 火球、轻微爆炸 立即燃烧 甚至爆炸
逐渐消失 很快消失
(二)Na为中心的知识网络
HCl



 Na2S Na2O
Na2O2
NaCl
Na2S Na2O
Na2O2
NaCl



|
|



 NaH
Na
NaOH
Na2CO3
NaHCO3
NaH
Na
NaOH
Na2CO3
NaHCO3
|
|
|
|

C6H5OH
C2H5ONa K C6H5ONa CH3COONa
(一)金属概要
1.金属的原子结构及位置特征

 最外层电子数较少(一般≤3) 位于周期表阶梯线左下方
最外层电子数较少(一般≤3) 位于周期表阶梯线左下方
 原子半径较大(同周期)
处于各周期的前中部
原子半径较大(同周期)
处于各周期的前中部
从右→左、上→下,半径增大 越左越下金属性越强
2.金属活动顺序及其应用
|
活动性顺序 |
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au |
||
 原子还原性 原子还原性 |
强
弱 |
||
 阳离子氧化性 阳离子氧化性
|
弱
强 |
||
 与O2化合难易 与O2化合难易 |
|
||
|
|
|
|

 与
与
H2O
反
应
冷水
强碱+氢气
热水
碱+氢气
高温水蒸汽
金属氧化物+氢气
 与酸反应
与酸反应与强氧化性酸均能反应但无H2生成 反应,溶于王水
与盐溶液反应
从盐溶液中置换出来
(常见还原剂)H2、CO、C、Al
分解法
富集法
3.金属单质制备
金属的活泼性如何,决定了它在自然界的存在形态及冶炼方法.如很活泼金属(Na),常温下与水即反应,故必须在无水体系中采用电化学方法,使其实现Na+→Na.而极不活泼的金属(Au),在自然界中即以单质形式存在,只需用物理方法.较活泼的金属(如Fe),在自然界主要以化合态存在于矿石中,在陨石中可发现单质铁.
 金属单质制备小结:
金属单质制备小结:

电解法
(K→Al)

MgCl2(熔融) Mg+Cl2↑
2Al2O3(熔融) 4Al+3O2↑
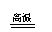
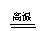
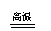
还原法
(Zn→Cu)
3CO+Fe2O3 2Fe+3CO2
2Al+WO3 W+Al2O3
3C+Cr2O3 2Cr+3CO
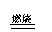 加热法
加热法(Hg→Ag)
HgS+O2 Hg+SO2

注意 Na+KCl K+NaCl
由于沸点:Na>K,符合勒沙特列原理。
13、单质硼有无定形和晶体两种,参考下表数据
|
|
金刚石 |
晶体硅 |
晶体硼 |
|
熔点 |
>3823 |
1683 |
2573 |
|
沸点 |
5100 |
2628 |
2823 |
|
硬度 |
10 |
7.0 |
9.5 |
①晶体硼的晶体类型属于____________晶体,理由是________________________。
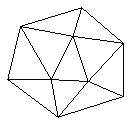 已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。通过视察图形及推算,此晶体体结构单元由
已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。通过视察图形及推算,此晶体体结构单元由
____________________个硼原子构成。其中B-B键的键角为____________。
10.短周期元素K、Y、Z在周期表中位置关系如图:
(1)x元素的单质分子式是_______,若x核内中子数和质子数相等,x单质的摩尔质量为_______,单质是_______晶体。
(2)自然界中存在一种含Y的天然矿物名称是:电子式为_______,属于
|
|
|
X |
|
|
Y |
|
|
Z |
|
|
_______晶体。
(4)z单质的晶体类型属于_______,Z的氢化物和最高价氧化物的浓溶液反应的化学方程式为____________________________
 <r
<r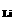 <r
<r <r
<r
 <r
<r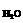
 <r
<r <r
<r
 表示,在二聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是__________
表示,在二聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是__________ 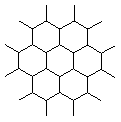 固体熔化时,必须破坏非极性共价键的是 ( )
固体熔化时,必须破坏非极性共价键的是 ( )