(二)化学量
1.比较元素原子量和原子原子量
 原子原子量
元素的原子量(平均)
原子原子量
元素的原子量(平均)
Mi-
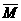 -A1..a%+A2.b%+……
-A1..a%+A2.b%+……
原子近似原子量 元素的近似原子量(平均)
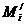 =质量数=Ai
=质量数=Ai
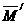 =A2.a%+A2.b%+……
=A2.a%+A2.b%+……
由此可知:对于有同位素的元素来说
(1)原子的原子量≠原子的质量数≠元素原子量
(2)质量数针对原子而言,元素无质量数
(3)元素的原子量不仅与其各同位素原子量有关,还与其在自然界中所占的原子百分比有关。
(4)原子百分比(a%、b%…)指各种原子的个数百分比或物质的量百分比,而非质量百分比,但两者可换算。
2.式量与摩尔质量
|
|
式量 |
摩尔质量 |
|
概念 单位 |
化学式中所有原子原子量总和 无 |
1mol物质具有的质量 g/mol |
|
关系 |
数值相等 |
3.物质的量及阿佛加德罗常数(NA)
①物质的量是一个基本物质量,单位:mol
②某物质含有阿佛加德罗数个构成该物质的微粒,该物质的物质的量为1mol
③构成该物质的微粒是指保持其化学性质的微粒。如
1mol纯硫酸含NA个H2SO4个分子
1molNaCl则含NA个Na+、NA个Cl-
④NA=12g碳所含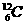 的原子数≈6.02×1023个/mol
的原子数≈6.02×1023个/mol
4.气体摩尔体积:
概念:在标准状况下(S.T.P),1mol任何气体所占的体积都约是22.4L.
①标准状况0℃(273K)、1.01×105Pa.
②任何气体:指可为纯净物,也可以互不反应的混合气体
③单位:L/mol
小结:物质的量与基本化学量间的关系
 微粒数N(个)
微粒数N(个)
气体体积 ×22.4(L/mol) 物质的量 ÷V(L) 物质的量浓度
V0(L) S.T.P n(mol) C(mol/L)
×M(g/mol)
物质的质量m(g)
关于式:
n=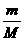 =
=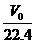 =
=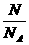 =C.V
=C.V
(一)化学用语
1.区分元素符号不同方位数字表达的含义
 元素化合价
元素化合价
该原子质量数 离子所带电荷数
±n
A n±
微粒个数 α
Z m
元素核电荷数 分子中原子个数
2.辨别表示物质组成或结构式子的优劣
|
|
意义 |
不足 |
实例 |
|||
|
最简式 |
能表示各原子或离子最简比 |
不能确定具体个数 |
乙烷CH3氯化钠NaCl |
|||
|
分子式(化学式) |
能表示分子的组成 |
不能反映原子间成键情况 |
H2O C2H4 |
|||
|
电子式 |
能表示原子、离子、分子、基等其中各原子最外层电子数及成键形式 |
不能说明分子的空间构型 |
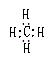
|
|||
|
结构式 |
能反映分子中各原子间结合方式 |
不能表明未成键电子情况
不能说明分子的空间构型 |
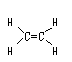 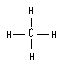 |
|||
|
结构简式 |
反映结构、突出官能团、省去单键 |
不能说明分子的空间构型 |
乙烯 H2C=CH2 乙醇CH3CH2-O-H |
注意:用电子式表示物质的形成过程
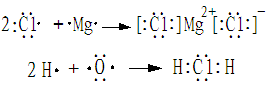
无论形成的是离子化合物还是共价化合物,左边均是原子的电子式,右边是该物质的电子式。
 溶于重水后,生成的一水合氨和水合氢离子均正确的是( )
溶于重水后,生成的一水合氨和水合氢离子均正确的是( ) 所含的电子数为NA个
所含的电子数为NA个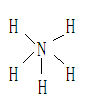
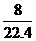 NA个
NA个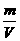 RT=ρRT
RT=ρRT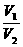 =
=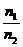 =
=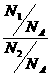 =
=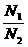 (N1、N2指气体分子数)
(N1、N2指气体分子数)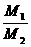 =
=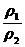 =D相(相对密度)
=D相(相对密度)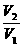
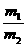
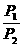 =
=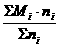 =∑Mi·ni%=∑MiVi%
=∑Mi·ni%=∑MiVi%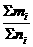 =
=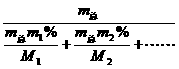
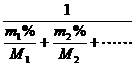
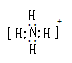
 Na2O2
Na2O2
Na2O2
Na2CO3
Na2O2
Na2O2
Na2O2
Na2CO3